(4597:東証マザーズ) ソレイジア・ファーマ 真の製薬企業へ 臨床試験結果にも注目
| 今回のポイント |
|
・がん領域に特化したスペシャリティファーマ(※)として、有望市場である日本、中国を中心としたアジア地域においてがん治療薬、がんサポーティブケア(がん支持療法医薬品等)などの開発及び販売を行う。荒井社長率いる実務経験豊富な開発スタッフ、開発成功確率の高さ、安定した事業基盤、事業の早期実現可能性などが強み・特長。・19年12月期の売上収益は、5~17億円のレンジの見込み。前期販売開始となったSP-03(日本)の収益、今期販売開始予定のSP-01(中国)及びSP-03(中国)の収益を見込む。またSP-02あるいはSP-04等の開発権利導出収益を一部、一定程度見込んでいる.
・バイオベンチャーにおいて自社販売体制を保有するという経営戦略は極めて特異であるが、今後の収益拡大の可能性を判断するためには、自社マーケティング体制の概要や進捗を知ることは不可欠なポイントであろう。同社では「経験豊富なマネジメントチーム」、「中国医学界から高評価を獲得」という他社にはない差別化要因を武器に巨大な中国市場の開拓を進めていく考えだ。 ・2019年は研究開発投資に加え、自社販売体制構築投資のため過去最高の損失となる可能性が高いが、事業化という面では、期初の予定通りSP-01の中国販売開始、SP-03の中国における承認取得および韓国での承認申請が発表され、SP-03については中国での販売もこの半年以内には開始されるだろう。同社が「開発」のみのステージから巨大市場・中国での「販売」も手掛ける真の製薬企業へと進化する大きな転換の年となる。加えて今後さらに注目すべきは「SP-02の日本・韓国・台湾・香港における最終試験である第Ⅱ相臨床試験結果」である。試験結果が良好であれば、同社にとっては初めてとなる抗がん剤本体製品化の道が開けることとなり、がんサポーティブケア製品であるSP-01やSP-03とは比べ物にならない大きなインパクトを生むこととなるだろう。もちろんその場合でも収益最大化までには最短でも5年程度かかることとはなるが、数多い日本のバイオベンチャーの中でも同社はトップクラスの評価を得ることとなろう。同社のリリースから目が離せない2019年である。 |
| 会社概要 |
|
がん領域に特化したスペシャリティ・ファーマ(※)として、有望市場である日本、中国を中心としたアジア地域においてがん治療薬、がんサポーティブケア(がん支持療法医薬品等)などの開発及び販売を行う。
荒井社長率いる実務経験豊富な開発スタッフ、開発成功確率の高さ、安定した事業基盤、事業の早期実現可能性などが大きな強み・特長。(※)スペシャリティ・ファーマ:得意分野において国際的にも一定の評価を得る研究開発力を有する新薬開発企業のこと。
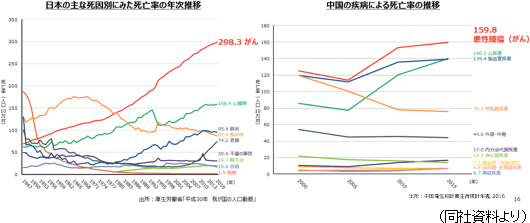
【1-2 企業理念・経営理念】 以下のような、『経営理念:ミッション、ビジョン、バリュー』を掲げている。 また、経営方針として以下の2点を示している。 ニッチではあるが困っている患者が多数いるアンメット・メディカル・ニーズ(いまだに治療法が見つかっていない疾患に対する医療ニーズ)解決のための新薬開発に注力していく。 【1-3 同社を取り巻く環境】 日本では高齢化、また食生活を含めたライフスタイルの変化等によりがん発症率は上昇していると言われているが、中国においてもがんの発症者数及び死亡者数は増加傾向にある。
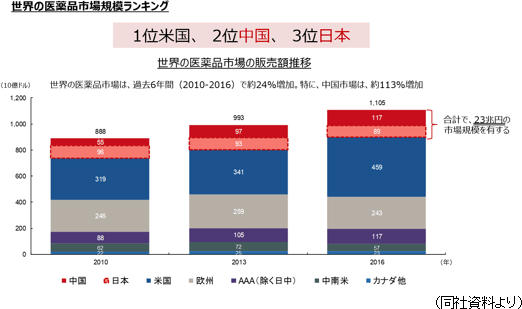
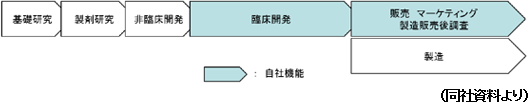
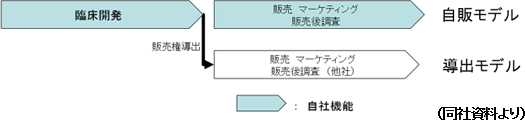
こうしたがんによる死亡率の上昇に伴い、「新規抗がん剤」および「がんサポーティブケア」への期待が高まっている。 (新規抗がん剤) (がんサポーティブケア) 以上のように、日本・中国におけるがん治療ニーズの増大とそれに対応した新規抗がん剤およびがんサポーティブケアへの期待は大きく、同社はこうしたニーズを取り込み、収益を拡大させるためのビジネスモデル、事業戦略を構築している。 【1-4 事業内容】 大手製薬会社は、巨額な研究開発費を変動費化することなどを目的にCROを利用した臨床開発段階のアウトソーシングを進めてはいるが、基本的には上記の工程全てを自社内に保有している。 そこで同社では、失敗の確率の高い基礎研究から非臨床開発の工程を自社では行わず、まだ開発段階にある将来有望な医薬品を外部から導入して臨床開発から開発に着手。それ以降の事業活動に経営資源を集約することで自社の強みを発揮するとともにリスクの低減を図っている。
販売工程については、高収益確保とリスクコントロールのバランスを考慮した仕組みを構築している。
一方医薬品は販売地域の網羅性(例:日本全国をカバー)が要求され、自社販売網を構築しようとすれば、固定費が増大する。
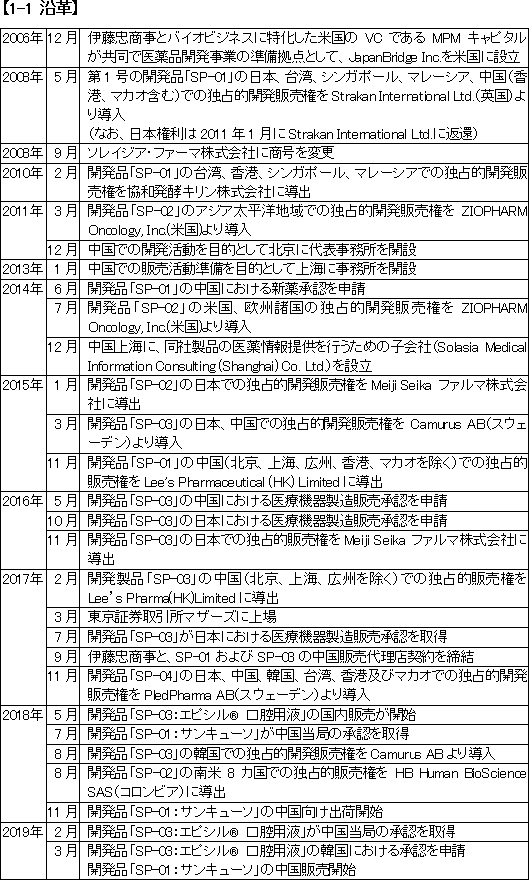
(自販モデル) 中国での自販活動は、100%子会社であるSolasia Medical Information Consulting (Shanghai) Co. Ltd.が担当。 (導出モデル) 今後も共同歩調が取りやすくWIN-WINの関係を構築できる中堅製薬メーカーを中心に導出先パートナーとして確保していく考えだ。 (2)製品・開発パイプライン パイプラインの開発・事業化の経緯、現状、今後の計画は以下のとおりである。(2019年3月18日現在)
(対象疾病の概要) 抗がん剤を投与すると、小腸にあるクロム親和性細胞と呼ばれる細胞がダメージを受ける。 (「SP-01」概要)
抗がん剤は5日間にわたり投与するケースが多いが、注射や経口による制吐剤は概ね1~2日間しか効果がなく、抗がん剤投与期間内に複数回注射しなければならない。これに対し「SP-01」は5日間にわたって安定的に血中のグラニセトロン濃度を維持することができるため、1回貼り付ければ制吐剤を追加する必要がなく、入院ではなく外来によるがん治療を可能とするため、患者のQOL向上にも大きく貢献する。 悪心・嘔吐、口内炎などが原因で、薬剤の服用が困難な状態にある場合でも、経皮吸収型製剤は使用可能である点も大きなメリットであり、以上のような点を評価され、米国NCCN診療ガイドライン、中国治療ガイドラインで処方推奨を得ている。 (開発および販売状況) 中国では2014年6月の承認申請完了を経て、18年7月に承認および市販用製剤の輸入許可を取得。これを契機に18年12月期第3四半期にはマイルストンを受領し売上収益を計上した。 販売開始にあたり、2019年3月16日、同社は「Sancuso上市セミナー」を上海で開催(共催)した。 Qin Shukui教授(CSCO副理事長) Ma Jun教授(CSCO副理事長) Li Jin教授(CSCO理事長) 同社では「SP-01」の特徴や競合薬に対する優位性にかかるKey Opinion Leaderと呼ばれる臨床医の評価の獲得、医療現場の臨床医への知見提供という上流・下流2方向の営業活動により800億円以上といわれる中国5HT3制吐剤市場でのシェア獲得を目指している。
(対象疾病の概要) (開発および販売状況) 米国における前期第II相臨床試験は2012年4月に完了し、白人種における一定の有効性を確認した。 日本での開発販売権はMeiji Seika ファルマ株式会社に導出済で、2018年8月には、コロンビア共和国のHB Human BioScience SAS社と、コロンビア、ペルー、エクアドル、ベネズエラ、チリ、パナマ、コスタリカ及びグアテマラでの販売等の独占的権利を導出した。
(対象疾病の概要) 口内炎は、「化学療法が口腔粘膜へ直接作用して障害が生じるもの」や「放射線照射により唾液腺組織に障害が生じ、唾液の分泌低下により口腔内の自浄作用が低下し局所感染が起こることで発生するもの」である一次口内炎と、「白血球減少などに伴う骨髄抑制により起こる口腔内感染が原因となるもの」である二次口内炎がある。 (「SP-03」概要)
口腔粘膜に適量を適用すると、数分以内に液体が口腔内の水分を吸収し生体接着ゲル化し、物理的なバリヤーを形成するもので、8時間程度の口内炎の疼痛緩和効果が臨床的に示されている。 (開発および販売状況) 中国においても2016年5月の承認申請後、2019年2月、医療機器輸入販売承認を取得した。 韓国においては2018年8月、導入元であるCamurus AB社と韓国での独占開発販売権利を導入する契約を締結し、2019年3月、当局へ承認申請を行った。 日本・中国・韓国以外では、米国、英国、ドイツ、デンマーク、ノルウェー、スウェーデン、フランスなどで他社及び導入元等により販売されている。
先行する3つの開発がおおむね順調に進む中、4つ目のパイプライン導入を上場時から検討していた同社は、「がん領域である。」、「臨床試験が一定程度進んでいる。」、「日本及び中国での開発権利を獲得できる。」という3つの条件を満たす新薬を探していた。そして、2017年11月にスウェーデンのPledPharma AB(以下、「Pled 社」)から、がん化学療法に伴う末梢神経障害薬「PledOx®」の日本、中国、韓国、台湾、香港及びマカオでの開発事業化の独占的権利を獲得した。早期の承認取得を実現するため、まず大腸がん治療における代表的な抗がん剤「オキサリプラチン」投与による末梢神経障害に適応を絞り、日本や中国など東アジア地域での臨床開発を進めていく。 (対象疾病の概要) このような副作用が発現した場合には、薬剤中止により、80%の症例では一部症状の改善がみられ、40%の症例では 6~8 ヵ月後には完全に回復するが、薬剤中止はがん化学療法の中止や方針変更となる可能性があり、末梢神経障害の治療は医療上の重要な課題である。ただ、がん化学療法の副作用としての末梢神経障害を適応として当局に承認された医薬品は現時点では存在していない。 (「SP-04」概要) 後述のように「SP-04:PledOx®」は後期第II相臨床試験を終了し、今後、第III相国際共同臨床試験が開始される予定(2018年12月開始済)で、末梢神経障害薬の開発トップランナー。開発成功は大きな先行者利益獲得につながるだけでなく、がん患者のQOL向上など社会的貢献度も高い。 (開発および販売状況) 一方、Pled 社は、18年11月に、FDA(米国食品医薬品局)及び EMA(欧州医薬品庁)との協議を経た第III相国際共同臨床試験を開始した。 日本人を被験者とする第Ⅰ相臨床試験が終了したソレイジア・ファーマは、第II相臨床試験実施を回避して第III相国際共同臨床試験への参画を検討していた。 2018年6月、独立行政法人医薬品医療機器総合機構(PMDA)との協議を経て、ソレイジア・ファーマの権利地域である日本、韓国、台湾、香港での当該第III相国際共同臨床試験への参画を決定し、同年12月に最終試験となる同臨床試験を開始した。
※プラセボ対照試験 最終試験である第III相国際共同臨床試験が開始されたことで、「SP-04」の事業化はさらに前進した。 【1-5 バイオベンチャーとしての6つの特徴】 ①創業の経緯 ②実務経験豊富な臨床開発陣 ③開発成功確率の高さ ④安定した事業基盤 ⑤高利益確保のための自販体制 ⑥事業の早期実現 以上6点以外に中国市場での成長ポテンシャルの高さを挙げることができる。 世界のメガファーマも当然中国をはじめとしたアジア各国に拠点を設けているが、同社が開発の対象とするのは経営方針にあるように、大手製薬企業が業績重視の観点から着手しないがん領域や希少疾病領域での新規製品である。近年医薬品市場で注目を浴びるこうした製品はバイオベンチャー発のものであるが、大手は取り扱わないため、同社は、北京・上海・広州の自社販売網を含め、世界中のバイオベンチャーにとって急成長するアジア市場へのアクセスを提供できる貴重な存在となろう。加えて、中国ビジネスに強みを持ち筆頭株主でもある伊藤忠商事と中国全土(香港、マカオを除く)における販売代理店契約を締結し、そのネットワークを活用できる点も同社の大きなアドバンテージである。 |
| 2018年12月期決算概要 |
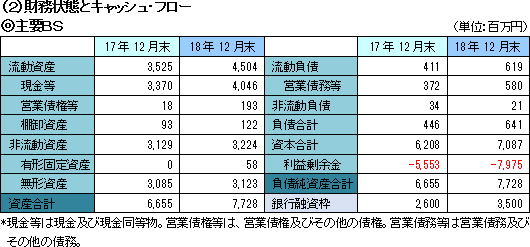
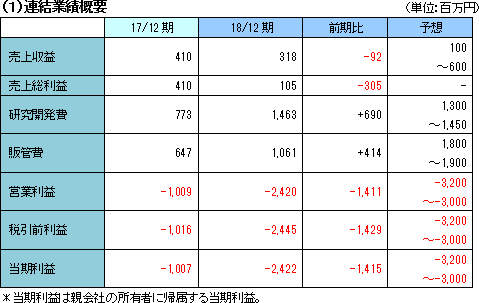 売上収益は前期比92百万円減の3億18百万円。SP-03の日本での製品販売及びSP-01の承認を契機とするLee’s Pharma社からのマイルストン収入及び中国向け製品販売等。 売上収益は前期比92百万円減の3億18百万円。SP-03の日本での製品販売及びSP-01の承認を契機とするLee’s Pharma社からのマイルストン収入及び中国向け製品販売等。研究開発費は、主にSP-02の国際共同第II相臨床試験(最終試験)等やSP-04の国際共同第III相臨床試験(最終試験)等の費用発生によるもの。販管費は、SP-01、SP-03の販売開始準備にかかる中国マーケティング活動費、中国セールス体制構築費、社内体制整備及びSP-03およびSP-01の事業進捗により開始された無形資産償却費発生など。 (資産性費用の無形資産計上と償却) (予想との差異)
公募増資により現金、資本が増加。棚卸資産の増加はSP-01の上市に備えた中国向け製品。資産合計は前期末に比べ10億73百万円増加し、77億28百万円となった。自己資本比率(親会社所有者帰属持分比率)は91.7%。
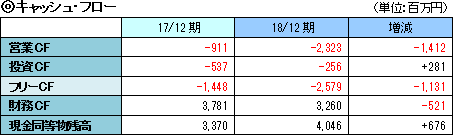
キャッシュポジションは前年同期に比べ6億76百万円上昇した。 |
| 2019年12月期業績予想 |
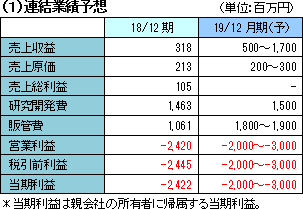 SP-01、SP-03販売で売上収益拡大。先行投資を拡大させるため損失は拡大傾向。 SP-01、SP-03販売で売上収益拡大。先行投資を拡大させるため損失は拡大傾向。売上においては各製品が販売開始間もないことから市場浸透速度には不確実性があり、コストにおいては臨床試験などの開始及び終了時期には不確実性があることから、現時点で特定することは困難であるため業績予想はレンジ形式によって発表している。 (売上収益) *下限予想5億円のケース *上限17億円のケース (営業費用) (営業損益等) (企業としての目標) |
| 中国における自社マーケティング体制 |
|
同社の特長の一つが、中国3大都市「北京・上海・広州」で自社販売を展開するという点だ。バイオベンチャーにおいて自社販売体制を保有するという経営戦略は極めて特異であるが、製品販売利益の最大化と固定費管理を通じた収益拡大の可能性を判断するためには、自社マーケティング体制の概要や進捗を知ることは重要なポイントであろう。ポイント①:経験豊富なマネジメントチーム
2014年に設立された中国における自社マーケティングを担当する100%子会社Solasia Medical Information Consulting (Shanghai) Co. Ltd.のマーケティング、販売部門は以下3名の責任者がリードしている。
子会社の社長にあたるVivian Zhang氏は臨床医として4年間大学病院に勤めた後、26年間製薬会社に勤務し、主にがん分野で豊富な経験を積んできた。中でも、世界的製薬企業ロシュ社においてはハーセプチン(抗悪性腫瘍剤)、タルセバ(抗悪性腫瘍薬)、アバスチン(抗悪性腫瘍剤)といった抗がん剤史上に名を残す有力抗がん剤の他、抗がん剤治療における副作用を抑制する制吐剤カイトリル(グラニセトロン塩酸塩)などで優れた販売実績を上げ、抗がん剤事業の責任者を務めた。 この3名のエキスパートの下、SP-01販売のため、現時点(2月13日)では上海9名、北京8名、広州7名の合計24名のMRを採用しているが、その7割が大手外資系製薬会社の出身でかつ、平均2年以上のがん分野でのセールス経験者である。 ポイント②中国医学界から高評価 ポイント③マーケティング活動の現在と今後 |
|
| <参考:コーポレートガバナンスについて> |
 ◎コーポレートガバナンス報告書 ◎コーポレートガバナンス報告書最終更新日:2018年4月2日 <基本的な考え方> <実施しない主な原則とその理由> |