カイオム・バイオサイエンス(4583) 早期黒字化 収益拡大を引き続き期待
|
 小林 茂 社長 |
株式会社カイオム・バイオサイエンス(4583) |
 |
企業情報
|
市場 |
東証グロース市場 |
|
業種 |
医薬品(製造業) |
|
代表取締役社長 |
小林 茂 |
|
所在地 |
東京都渋谷区本町3-12-1 住友不動産西新宿ビル6号館 |
|
決算月 |
12月末 |
|
HP |
株式情報
|
株価 |
発行済株式数 |
時価総額 |
ROE(実) |
売買単位 |
|
|
109円 |
56,387,000株 |
6,146百万円 |
-83.6% |
100株 |
|
|
DPS(予) |
配当利回り(予) |
EPS(予) |
PER(予) |
BPS(実) |
PBR(実) |
|
0.00 |
– |
– |
– |
21.66円 |
5.0倍 |
*株価は8/22終値。発行済株式数、DPSは24年12月期第2四半期決算短信より。ROE、BPSは前期実績。創薬事業における合理的な業績予想の算定が困難なため、24年12月期の業績予想は創薬支援事業の売上高720百万円のみ開示している。
業績推移
|
決算期 |
売上高 |
営業利益 |
経常利益 |
当期純利益 |
EPS |
DPS |
|
2020年12月 |
480 |
-1,283 |
-1,291 |
-1,293 |
-36.06 |
0.00 |
|
2021年12月 |
712 |
-1.334 |
-1.329 |
-1.479 |
-36.74 |
0.00 |
|
2022年12月 |
630 |
-1,258 |
-1,243 |
-1,242 |
-28.26 |
0.00 |
|
2023年12月 |
682 |
-1,205 |
-1,217 |
-1,220 |
-24.62 |
0.00 |
|
2024年12月(予) |
– |
– |
– |
– |
– |
0.00 |
*単位:百万円、円。創薬事業における合理的な業績予想の算定が困難なため、24年12月期の業績予想について会社側は創薬支援事業の売上高720百万円のみ開示している。
株式会社カイオム・バイオサイエンスの2024年12月期第2四半期決算概要、事業の進捗などをお伝えします。
目次
今回のポイント
1.会社概要
2.2024年12月期第2四半期決算概要
3.2024年12月期の見通し
4.今後の注目点
<参考:コーポレートガバナンスについて>
今回のポイント
- 2024年12月期第2四半期の売上高は前年同期比95百万円減の2億63百万円。創薬支援事業において一部新規案件の検収時期の後ズレや顧客内の組織変更の影響を受けた。営業損失は同78百万円縮小の5億81百万円。研究開発費が同1億55百万円減少。これは主にCMC費用が前年同期よりも減少したことによるもの。
- 創薬事業における合理的な業績予想の算定が困難なため、2024年12月期の業績予想については、創薬支援事業の売上高7億20百万円のみ開示している。
- 創薬事業においては、CBA-1205では、臨床第1相試験前半パートで登録されたメラノーマ(悪性度の高い皮膚がんの一種)の患者で腫瘍縮小を伴うSD(安定)評価が続き36ヶ月を超えて長期継続投与中である。メラノーマへの本剤の開発可能性について治験責任医師と科学的な検討を行っている。
- CBA-1535では、固形がんの患者を対象に段階的に用量を上げながら、安全性と本剤のコンセプトであるT細胞の活性化、初期の有効性を評価中で、現時点では軽微な副作用のみ確認され、安全性を懸念するデータは無い。
- ADCT-701では、米国国立がん研究所(NCI)が神経内分泌がんを対象とした第1相試験を開始し、2024年7月に第1例目被験者への投与が行われた。
- 創薬支援事業は、顧客の組織変更等の影響により減収減益とはなったが、抗体創薬の技術・サービスが有用との評価を得ており、今上期には新たに武田薬品と業務委託基本契約を締結するなど、新規顧客開拓も進んでいる。
- 24年6月、第三の収益源創出および社会課題の解決を行うことを目的とし、バイオシミラー医薬品の開発実績を有するキッズウェル・バイオ株式会社との業務提携を通じ、新たにバイオシミラー医薬品開発に参入すると発表した。バイオシミラー医薬品とは既に承認・販売されているバイオ医薬品(先行バイオ医薬品)の特許期間・再審査期間満了後に、異なるメーカーから販売される、先行バイオ医薬品と同等/同質、安全性および有効性を有する医薬品。薬価は原則として先行バイオ医薬品の 70%に設定されるため、患者の経済的負担や医療費の軽減が期待される。また、製薬会社にとっても、新薬開発よりも開発投資額が抑えられ成功確度を高く見込むことができる。
- 同社では、今来期、PCDCをはじめとする非臨床段階のパイプラインの他、臨床開発中のCBA-1205、CBA-1535も含め、導出契約の獲得を想定した取り組みを進めている。また、堅調に拡大を続ける創薬支援事業に加え、新たにバイオシミラー医薬品事業にも参入した。早期の黒字化、収益拡大を引き続き期待したい。
1.会社概要
ミッションに「医療のアンメットニーズ(※)に創薬の光を」を掲げ、独自技術であるADLib®システム等の複数の抗体作製技術を駆使して最適な抗体を取得し、アンメットニーズの高い疾患に対する抗体医薬品の開発候補品創出に取り組むバイオベンチャー。高い抗体開発候補品創出能力などが強み。
※アンメットニーズ
現状では有効な治療法がなかったり、薬剤による治療満足度が低かったりする治療に対する未充足なニーズ
【1-1 沿革】
2005年2月、国立研究開発法人理化学研究所の太田邦史研究員(現:東京大学執行役・副学長)が率いる遺伝ダイナミクス研究ユニットと財団法人埼玉県中小企業振興公社(現:財団法人埼玉県産業振興公社)との共同研究により開発された抗体作製基盤技術ADLib®システム(アドリブシステム)の実用化を目的として設立された。
2011年12月に東証マザーズに上場。
設立当初よりADLib®システムの技術導出(ライセンス供与)を中心的なビジネスモデルと位置付けて活動してきたが、2017年2月、業績向上に向け代表取締役交代など経営陣の刷新に踏み切った。
また、ADLib®システムの技術導出に依存したビジネスモデルから、創薬開発を推進する経営へと軸足をシフトさせる必要があると判断し、経営ビジョン、経営方針、ビジネスモデルの変更も行った。
2020年には自社開発品の初期臨床試験を開始し、臨床開発ステージのバイオベンチャーとして成果創出に取り組んでいる。
【1-2 経営理念など】
| Mission | 医療のアンメットニーズに創薬の光を |
| Vison | アンメットニーズに対する抗体医薬の開発候補品を生み出すNo.1ベンチャー企業を目指す |
| 経営方針 | ●健全な経営と信頼性の確保を第一に、社会とともに成長する企業を目指す。
●創造と科学をもってアンメットニーズに対する治療薬を開発して、患者さんと社会へ貢献する。 ●外部連携により継続的なパイプライン創出と企業価値向上を実現する。 |
後述するように、同社の主力製品である抗体医薬はがんや自己免疫疾患の領域では目覚ましい治療効果をもたらしている。しかし、膵臓がん、肺がん、アルツハイマー病、糖尿病合併症、筋萎縮性側索硬化症(ALS)等、未だに治療満足度、薬剤貢献度が低い疾患が残されているほか、既存の抗体治療薬よりも優れた抗体に対するニーズも存在する。
同社は、この経営理念の下、抗体作製・タンパク質調製関連技術で構成される自社技術プラットフォームを最大限に活用して、アンメットニーズの高い分野に対する抗体創薬に取り組んでいる。
【1-3 市場環境】
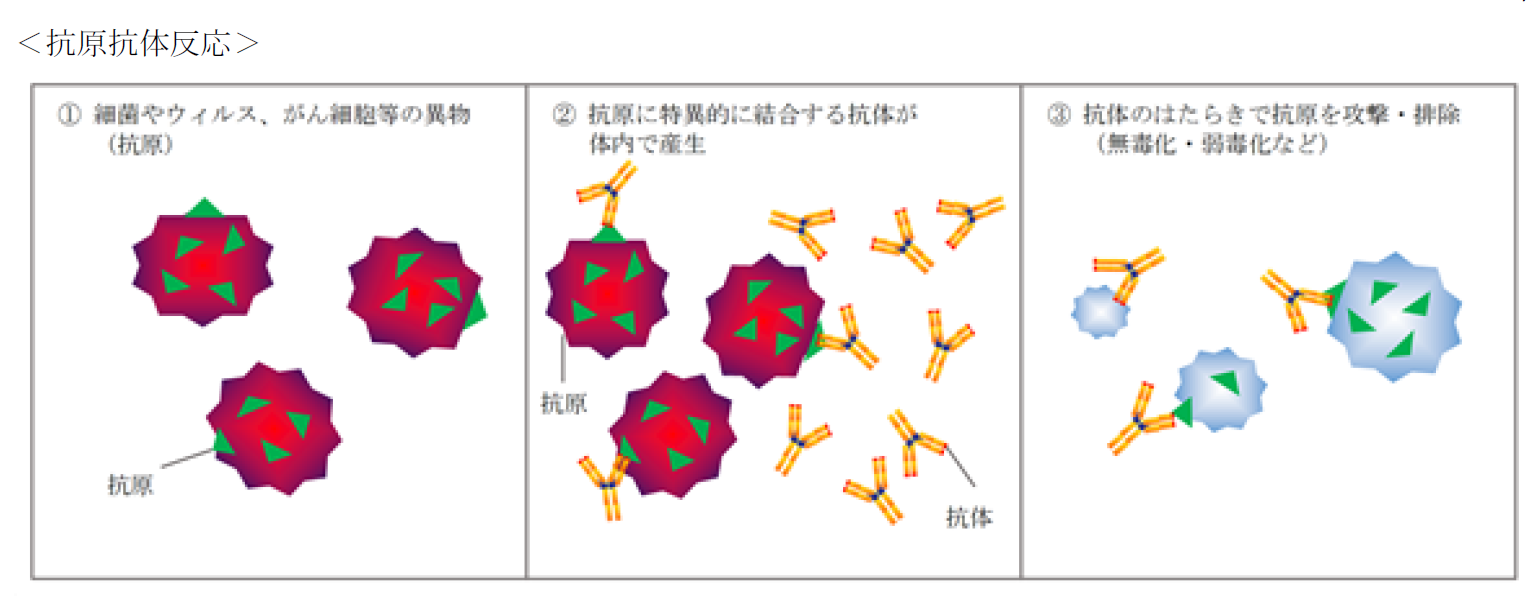
◎抗原抗体反応と抗体医薬品
同社の事業内容を理解するうえで知っておく必要のあるキーワードが「抗原抗体反応」、「抗体医薬品」などである。
ヒトには、体内に侵入した細菌やウイルス等のタンパク質を異物(抗原)として認識し、その異物を攻撃、排除するために、体内で抗体を作って身体を守る防御システムが備わっており、これを「抗原抗体反応」と呼ぶ。
(同社有価証券報告書より)
こうして産生された抗体は、特定の抗原にのみ結合する性質を持っており、正常な細胞とがん細胞を見分けたり、病気の原因となるタンパク質の機能を抑えたりすることができる。
この抗体の特徴を医薬品に活用したものが「抗体医薬品」である。
従来の抗がん剤等の中には、正常な細胞にも作用して副作用を引き起こすものも多く、副作用を抑制するために本来の目的であるがん治療を進めることができないといったケースも見られるが、抗体医薬品は、疾患に関連する細胞に特異的に発現が認められる抗原をピンポイントで狙い打ちするため、高い治療効果と安全性が見込まれ、近年市場が拡大している医薬品である。現在、世界で承認されている抗体医薬は100品目を超えており、がんや自己免疫疾患の領域で目覚ましい治療効果をもたらしたものもある。
(抗体医薬品が使われている主な疾患)
|
分類 |
病気 |
|
がん |
大腸がん、乳がん、非小細胞肺がん、メラノーマ、腎がん、前立腺がん、胃がん、急性骨髄性白血病、非ホジキンリンパ腫、皮膚T細胞リンパ腫等 |
|
アレルギー・免疫 |
関節リウマチ、多発性硬化症、クローン病、喘息、腎臓移植後の急性拒絶(正)反応 |
|
その他 |
黄斑変性症、骨粗鬆症、感染症 |
◎成長が続くバイオ医薬品市場
バイオ医薬品は、遺伝子組換え技術等のバイオテクノロジーにより創出された医薬品であり、1980年代から実用化が始まった。その後、抗体作製技術等の技術革新により、分子量が大きく、構造が複雑な抗体医薬品の創出が可能となり、新たな治療手段として、前記のような有用性の高さが臨床的に示されている。
バイオ医薬品の牽引役である抗体医薬においては、京都大学高等研究員の本庶佑特別教授がノーベル医学生理学賞を受賞したことで話題になったオプジーボなどに代表される免疫チェックポイント阻害剤(※)が複数製品化され、順次市場は拡大されている。加えて、他の抗体医薬品との併用療法によるがん治療の向上を目指した開発研究が多数実施されているほか、抗体薬物複合体(ADC)やバイスペシフィック抗体(※)に代表される多価抗体などの次世代型抗体については、従来よりも有用性を高めた医薬品として上市されている。
高い薬効および安全性というアドバンテージから、世界の医薬品売上高上位には抗体医薬品製剤が多数ランクインしており、今後も免疫チェックポイント阻害剤を含めた抗体医薬品市場は一層の拡大が期待されている。
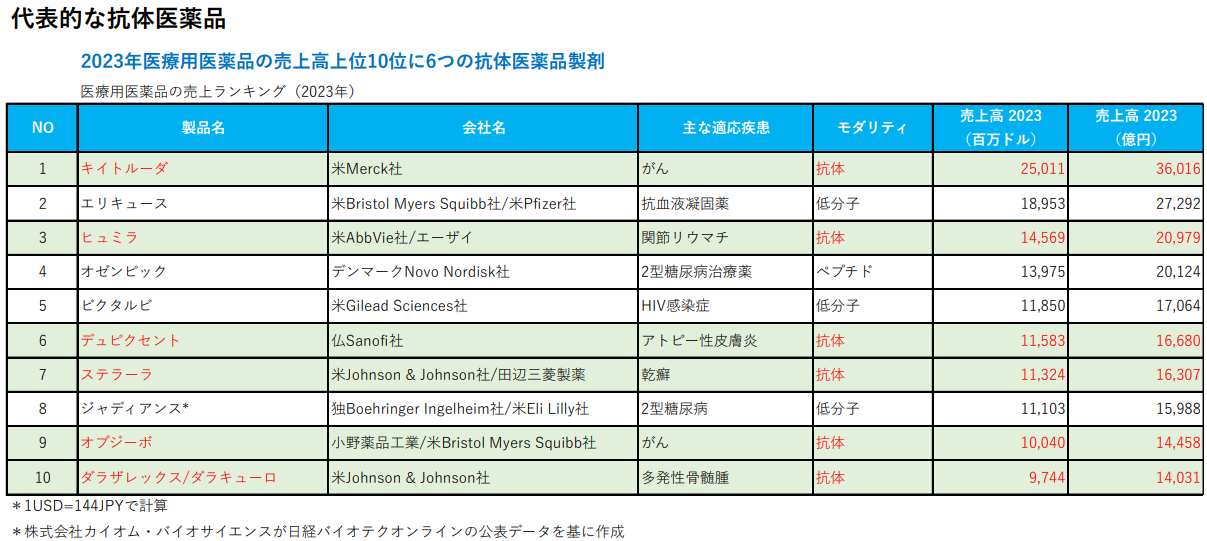
※オプジーボ
一般名はニボルマブ。がん細胞が免疫システムを無効化する仕組みを阻止する働きを持つ免疫チェックポイント阻害剤の一つ。日本では、2014年7月に切除術による根治が期待できない悪性黒色腫の治療薬として承認され、同年9月から小野薬品工業が販売を開始した。その後、15年12月に非小細胞肺がん、16年9月に腎細胞がんにも適応が拡大された。
※免疫チェックポイント阻害剤
免疫療法の一種。これまでの免疫療法は免疫細胞の攻撃力を高める「アクセルを踏む働き」が中心であったのに対し、がん細胞によって免疫細胞にかけられたブレーキ(免疫チェックポイント)を外すことにより、免疫細胞の本来の力を発揮させ、がん細胞を攻撃できるように作用するもの。従来の治療法では効果が十分に見られなかった患者にも治療効果を上げることに成功している。
※バイスペシフィック抗体
通常、抗体は抗原を認識する部位を2つ持っており、それらは同じ抗原を認識する。それに対し、2つの抗原認識部位がそれぞれ別のターゲット(抗原)を認識するものをバイスペシフィック抗体と呼ぶ。
【1-4 事業内容】
報告セグメントは、独自の抗体作製技術ADLib®システムや複数の抗体作製技術を用いて治療薬や診断薬等の抗体医薬品候補を開発し、これを導出する「創薬事業」および、抗体作製技術を用いて製薬企業や診断薬企業、大学等の研究機関で実施される創薬研究を支援する「創薬支援事業」の2つ。
◎抗体作製技術について
抗体医薬品を創り出すために不可欠な抗体作製技術には様々な種類が存在する。
同社独自技術であるADLib®システムは、従来の抗体作製技術とは異なるテクノロジーで「従来の免疫法では困難な抗原に対する抗体取得が可能」、「迅速な抗体取得」などの技術的特徴を有している。ADLib®システムに加え、次世代抗体として積極的な研究開発が行われている多価抗体作製技術のTribody™を保有している。、ハイブリドーマ法やB Cell Cloning法などのコンベンショナルな技術を含めてそれぞれの技術の特性を活かして統合的に運用することにより抗体作製力の強化を進めている。
<抗体作製技術とその特徴>
|
抗体作製技術 |
特性 |
| ADLib®システム | ●抗原があれば10日前後と短期間でヒトIgG抗体を獲ることができる。
●自律的多様化という独創的な抗体ライブラリの特徴を生かし、抗原特異的抗体の取得から抗体の高親和性化までを連続的に行うことが可能。 ●動物免疫と異なり、自己抗原への免疫寛容の影響を受けないため、理論的にはあらゆる配列のタンパク質を認識する抗体が取得できる可能性がある。 |
| Tribody™
(多重特異性抗体作製技術) |
●3つ以上の異なる抗原結合部位を持つ抗体であるTribody™およびその発展型多重特異性抗体のデザイン・エンジニアリング・創薬開発を可能にする技術プラットフォームをいう。
●CBA-1535のように腫瘍細胞の近傍でT細胞を活性化することにより、がん細胞を叩くT cell engagerというカテゴリや、複数の疾患関連細胞を架橋することでがん以外の疾患の治療薬も設計可能。 |
| ハイブリドーマ法 | ●動物免疫による抗体作製法で、最もよく用いられる。
●手法が確立されており、医薬品化された実績も多い。 ●ヒト抗体産生動物を用いた場合、ヒト化の工程を経ずにヒト抗体を取得することができる。 |
| B Cell Cloning | ●動物免疫を行った後、ハイブリドーマを作製せずに抗体の配列を決定するため、ハイブリドーマ法より短期間で目的の抗体を得ることができる。
●抗原特異的なB細胞の検出率がハイブリドーマ法よりも高く、取りこぼしが少ない。 ●ヒト抗体産生動物を用いた場合、ヒト化の工程を経ずにヒト抗体を取得することができる。 |
(1)創薬事業
◎事業範囲
医薬品の研究開発プロセスのうち、「抗体の作製・評価」「開発・製造」「臨床試験の一部」を事業範囲としている。
タンパク質調整、抗体作製、創薬研究、臨床開発の研究開発機能を有し、新規抗体創製から初期臨床開発を実施できる研究開発体制を構築している。
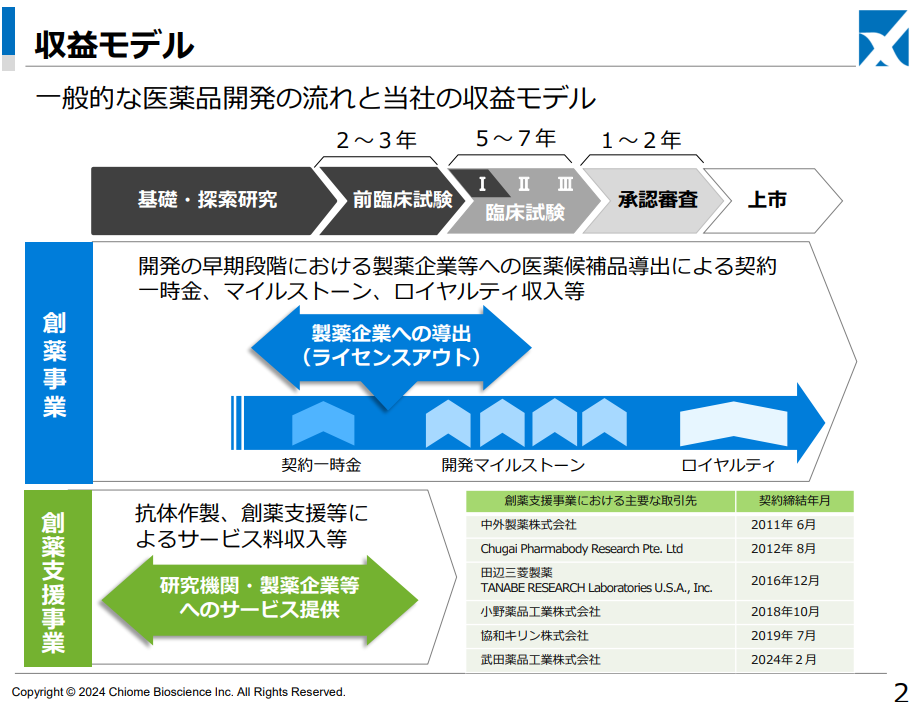
◎ビジネスモデル
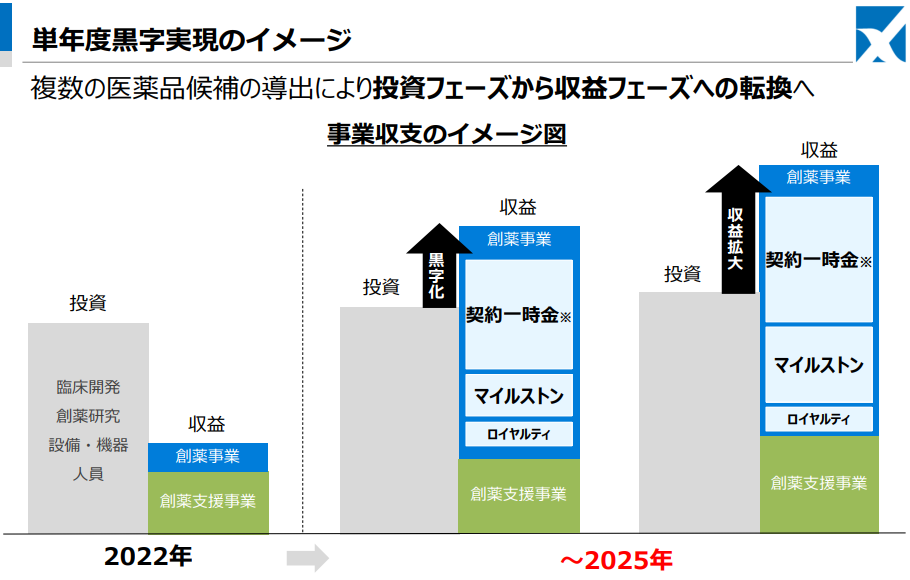
様々な抗体作製技術を駆使して、アンメットニーズの高い疾患領域における抗体創薬開発を行い、前臨床開発または初期臨床開発段階で開発した医薬候補品を製薬企業等に導出。契約一時金、マイルストーン収入(開発&販売)、およびロイヤルティ収入等を獲得する。抗原や研究用抗体の取得についてはアカデミア(大学・研究機関)に対する積極的なアプローチにより連携を強化、有望なシーズについての事業化権を獲得する。
複数の医薬品候補を導出することにより、投資フェーズから収益フェーズへの転換を図る。
(同社資料より)
◎開発の基本戦略・方針
特にがん領域においては自社で開発候補抗体(ヒト化抗体、ヒト抗体)の非臨床データパッケージまで作製できる研究体制を構築し、前臨床段階での導出を基本戦略としているが、初期臨床試験まで自社で対応できる開発体制の構築し、2020年には自社パイプラインの臨床開発を開始した。
これは、同社が導出したいタイミングで必ずしも適切な導出先が見つかるかは明確ではないこと、ある程度開発を進めて付加価値を付けた後に導出したほうが事業として明らかに良好な場合もあることを想定しているためである。
また、今後の展開については、開発遅延・中止リスクを鑑み、継続的に10程度の探索ステージのプロジェクトを運営し、創薬成功確率を高めることを方針として掲げている。
◎パイプラインおよび開発状況

(同社資料より)
(外部臨床試験)
|
ADCT-701(ヒト化抗DLK-1モノクローナル抗体の薬物複合体) |
|
|
概要 |
がん細胞の細胞表面で発現しているタンパク質「DLK-1」をターゲットとするヒト化モノクローナル抗体のADC抗体(※)であり、カイオムが開発した抗体LIV-1205とPBD*の抗体薬物複合体。 (*Pyrrolobenzodiazepine:抗腫瘍特性を有する薬物) |
|
想定適応疾患と解決すべきアンメットニーズ |
肝臓がん、小細胞肺がん、神経芽細胞腫など、多くの固形がんを標的としている。 標準療法で十分な効果が得られない患者に効果を有する治療薬を提供する。 |
|
知財 |
ヒト化抗DLK-1抗体は、日本・米国・欧州・中国他で特許が成立。 |
|
開発の進捗 |
米国国立がん研究所(NCI)が米国でのIND申請を完了し、2,024年7月には第1相臨床試験における第1例目の被験者への投与が始まった。 今後、NCIによる第1相試験データを用いてADCT-701の開発を製薬会社が進める場合には、当社と製薬会社でライセンス契約を締結することとなる。 |
(自社開発品)
|
CBA-1205(ADCC活性増強型ヒト化抗DLK-1モノクローナル抗体) |
|
|
概要 |
「DLK-1」をターゲットとするファーストインクラスのヒト化モノクローナル抗体。DLK-1は幹細胞や前駆細胞のような未熟な細胞の増殖・分化を制御し、これまでに肝臓がんをはじめとする複数のがん細胞表面においても発現し、その増殖に関与していることが明らかとなった新しいがん治療の標的になる可能性がある分子。 |
|
想定適応疾患と解決すべきアンメットニーズ |
難治性の癌腫である肝細胞がん、肺がん等。 肝臓がんなど、有効な治療薬がない悪性度の高い腫瘍に対して新たな治療薬を提供する。 |
|
知財 |
日本・米国・欧州・中国他で特許成立。
|
|
開発の進捗 |
2020年7月にスタートした国内臨床試験第1相試験では、固形がん・肝細胞がん患者を対象に、安全性・忍容性・体内動態および有効性評価を実施する。
同試験の前半パートが終了した。固形がん患者を対象とした治験経過から標的および本抗体の安全性の高さが示された。前半パートで登録されたメラノーマ(悪性度の高い皮膚がんの一種)の患者で腫瘍縮小を伴うSD(安定)評価が続き、36ヶ月を超える長期継続投与を確認し、現在も投与継続中である。 メラノーマに対する開発可能性について治験責任医師と科学的な検討を行うこととした。
2022年に開始された後半パートでは、前半パートでの最大量を参考に、肝細胞がん患者の臨床試験における最適な投与量を確認するほか、安全性と初期の薬効シグナルを評価している。この薬効シグナルの確認が早期導出の鍵となる。 後半パートで登録された肝細胞がん患者1例においてPR(部分奏功:30%以上の腫瘍縮小)を確認した。 |
|
今後の導出方針 |
導出先として「早期に開発パイプラインを拡充したい企業群」と「事業性、成功確率を重視する企業群」の2グループを想定している。
評価・検討ポイントは、前者においては先行品が無いこと、ヒトでの高い安全性など、後者では患者における奏効率やバイオマーカーとしての効果など。 導出一時金は後者の方が多額になると想定している。
前述のように、国内臨床試験第1相試験の後半パートの治験期間を延長したことにより、治験実施と並行して導出活動を推進する。 肝細胞がん患者における複数のPR症例の獲得と導出一時金の最大化を狙う。 |
| CBA-1535(ヒト化抗5T4・抗CD3多重特性抗体) | |
| 概要 |
3つの分子を認識するTribody™技術を用いて創製したがん治療用抗体。 臨床標的としての安全性が確認されている既知(公知)のがん抗原5T4と免疫細胞であるT細胞 上のタンパク質CD3を標的とする多重特異性抗体。 |
| 想定適応疾患と解決すべきアンメットニーズ |
悪性中皮腫、小細胞肺がん、非小細胞肺がん等。 T細胞の増殖と活性化を誘導して強力な細胞傷害活性を発揮する(T Cell engager)。Tribody™としては初めての臨床開発品目であり、難治性がんに対する薬効が期待される。 |
| 知財 | 日本・米国・英国・中国・欧州等で成立。 |
| 開発の進捗 | 2022年6月、Tribody™抗体として世界初の臨床試験(臨床第1相試験)が始まり、第一例目の被験者への投与が開始された。
前半パートでは、固形がん患者を対象に単剤を投与。低用量から段階的に投与し、安全に投与できる最大量を求め、初期の薬効シグナルを評価中である。後半パートでは、同じく固形がん患者を対象に、がん免疫療法薬との併用を行う。 前半パートで安全性が確認できた用量から段階的に用量を上げながら、安全性と本剤のコンセプトであるT細胞の活性化、初期の有効性を評価中である。現時点では軽微な副作用のみ確認され、安全性を懸念するデータは現れていない。
当初は「後半パートは2023年中ごろに開始し2024年中に完了」の予定であったが、「前半パートでの薬効シグナル確認後、後半パートを2024年開始予定」と計画を変更した。 同社では、本試験での安全性の確立が T cell engagerとしてのTribody™創薬の一里塚となると考えている。事業提携や紹介活動など導出に向けた取り組みも並行して進めている。 |
(導出候補品)
| PCDC(ヒト化抗CDCP1抗体の薬物複合体) | |
| 概要 | ADC抗体を用いた新規パイプライン。標的分子はCDCP1ファーストインクラス抗体。 |
| 期待 | CDCP1は First in classとなる標的分子であり、標準治療耐性のがん種を含む幅広い固形がんで発現している。( 肺、結腸直腸、膵臓、乳、卵巣 がんなど)結合特性および毒性プロファイルに基づく、広い有効域&安全域が期待される。 |
| 知財 | 中国で成立、日本・米国・欧州他で出願中 |
| 進捗 | ADC用途を中心とした導出活動を推進中。国内外のカンファレンス等で導出候補企業へのコンタクトを進めているほか、ADC技術を保有する海外製薬企業との交渉を進めている。
カイオム・バイオサイエンスでは、「①独自のADC技術を持っているADC用の抗体が欲しい製薬企業」及び「②ADCとしてパイプラインを拡充したい製薬企業」を対象としてきたが、導出先企業のADC技術と同社抗体の組み合わせによる開発ニーズが高いことから、①の企業への導出活動を優先することとした。 |
| PTRY(ヒト化抗5T4・抗CD3・抗PD-L1多重特性抗体) | |
| 概要 | 3つの分子を認識するTribody™技術を用いて創製したがん治療用抗体。
抗原結合部位の標的を①固形がんに発現が認められる 5T4②免疫細胞であるT細胞上のCD3③免疫チェックポイント阻害に関与するPD-L1、としたがん治療用抗体である。 この3つの組み合わせで、強い腫瘍増殖効果を発揮する。 |
| 想定適応疾患 | 悪性中皮腫、小細胞肺がん、非小細胞肺がん、トリプルネガティブ乳がん(TNBC)等 |
| 期待 | 従来のがん免疫療法では十分に効果が期待できなかった患者への新たな治療薬としての開発が期待されている。また、薬価抑制による医療経済への貢献にも有用と考えられている。 |
| 知財 | 特許出願を完了 |
| 進捗 | イタリアの公的研究機関Ceinge-Biotecnologie Avanzateと行ったがん免疫療法に関する共同研究の成果が、国際的な学術雑誌であるJournal of Experimental & Clinical Cancer Research誌に掲載された。
カイオム・バイオサイエンスでは、CBA-1535の次世代型パイプラインとして、今後の開発・導出に注力する考えだ。 |
| PFKR(ヒト化抗CX3CR1抗体) | |
| 概要 | Fractalkine (CX3CL1) receptorの機能阻害抗体であり、自己免疫性神経疾患等の病態進行を抑制する治療用抗体 |
| 想定適応疾患 | 二次進行型多発性硬化症(SPMS)等 |
| 期待 | SPMSは難治性病型の多発性硬化症であり、安全性の高い有効な治療薬の開発が求められている疾患。
SPMSにおける病変(脱髄、神経変性)に直接的に関わると考えられる細胞傷害性のEomes陽性CD4+T細胞の機能を抑制することで症状の進行を抑制する事を期待。 |
| 知財 | 特許出願を完了 |
| 開発の進捗 | 国立精神・神経医療研究センターとの共同研究を進めている。 |
| PXLR(ヒト化抗CXCL1/2/3/5抗体) | |
| 概要 | CXCR2発現細胞の走化性因子であるCXCL1/2/3/5の機能阻害抗体であり、薬剤耐性のがん微 小環境を改善させるがん治療抗体 |
| 想定適応疾患 | 固形がん(胃がん、乳がん、卵巣がん、など) |
| 期待 | がん細胞はCXCL1/2/3/5を発現し、薬剤耐性環境の原因細胞である免疫抑制細胞を呼び寄せ る。PXLR抗体の投与により免疫抑制細胞を減少させ、薬剤耐性を克服およびがんの再発抑 制が期待される。 |
| 知財 | 特許出願を完了 |
| 開発の進捗 | 大阪公立大学との共同研究を進めている。 |
| BMAA(ヒト化抗セマフォリン3Aモノクローナル抗体) | |
| 概要 | 神経軸索の伸長を抑制するセマフォリン3Aに結合するヒト化モノクローナル抗体。
公立大学法人横浜市立大学、五嶋研究室との共同研究において、ADLib®システムにより取得した。 免疫系疾患、神経疾患等、セマフォリン3A との関連が知られている幅広い疾患領域での適応が期待される。 |
| 想定適応疾患 | 腎疾患等 |
| 知財 | 日本・米国・欧州で特許成立。 |
| 開発の進捗 | セマフォリン3Aが関与する疾患に狙いを定めた研究機関との共同研究を実施中で、本共同研究により取得した本抗体の新たな薬効データを付加し導出活動を進めていく。 |
| LIV-2008/2008b(ヒト化抗TROP-2モノクローナル抗体) | |
| 概要 | 種々の固形がんの細胞表面に発現する「TROP-2」に結合するヒト化モノクローナル抗体。がん細胞の増殖活性を阻害することが動物モデルを用いた試験により確認されている。
「TROP-2」は、正常組織に比べ、乳がん、大腸がんのほか、膵がん、前立腺がん、肺がん等の複数の固形がんにおいて発現が増大しており、がんの悪性度に関連していることが複数報告されている分子。naked抗体に加えてADC(抗体薬物複合体)等の強い薬効を期待した開発を狙う。 |
| 想定適応疾患と解決すべきアンメットニーズ | 乳がん(TNBC)、大腸がん、膵がん、前立腺がん等
薬物等との複合体により、TROP-2が発現する腫瘍に対して先行品で十分な治療できない患者に対する治療薬を提供する。 |
| 知財 | 日本・米国・欧州・中国他で特許成立。 |
| 開発の進捗 | 2021年1月にShanghai Henlius Biotech, Inc.と、中華人民共和国、台湾、香港およびマカオにおける開発、製造および販売権、および全世界における権利についてオプション権を付与するライセンス契約を締結したが、2023年1月、ライセンス契約を終了した。先行品の開発状況などの事業戦略上の判断により、Henlius社では開発を進めないことが決定したため。
現在同社が積極的に導出活動を進めるCBA-1205/CBA-1535/PCDCの紹介活動と合わせて、本抗体の導出活動を行っている。 |
| 創薬研究プロジェクト | |
| 概要 | パイプライン拡充のために国内研究機関と連携をしながら、がん、中枢神経、自己免疫疾患などアンメットニーズが存在する疾患領域での共同研究を実施しており、有望なものをプロジェクト化する。 |
| 進捗 | 研究の進捗状況等に基づき、創薬プロジェクトの改廃を実施しており、知財化に向けた研究開発を進めているほか、新規プロジェクト発足に向けた活動を推進している。
同時に、導出に向けて秘密保持契約下での協議を行っており、MTA評価や経済条件の交渉等を進めている。 |
この他、Chiome’s mAb Discovery Engine(技術ポートフォリオ)充足および技術改良のための共同研究を実施中である。また、他社技術も取り込み、同社のコアコンピタンスである技術力の強化を図っている。
※ADC抗体
抗体薬物複合体。悪性腫瘍や炎症性疾患等の目的の組織や細胞表面タンパク質(抗原)に特異的に結合する抗体に抗がん剤などの薬物を結合させることにより、薬剤を病変部位に選択的に到達させ、細胞内に放出させることでがん細胞等を死滅させることができる。
※Tribody™技術
3つの異なる抗原結合部位を持つ抗体を創製する技術で、複数の抗原に結合することができる多重特異性や腫瘍細胞を攻撃するT細胞誘導活性を有する抗体(multispecific T-cell engager antibody)を創り出すことができる。
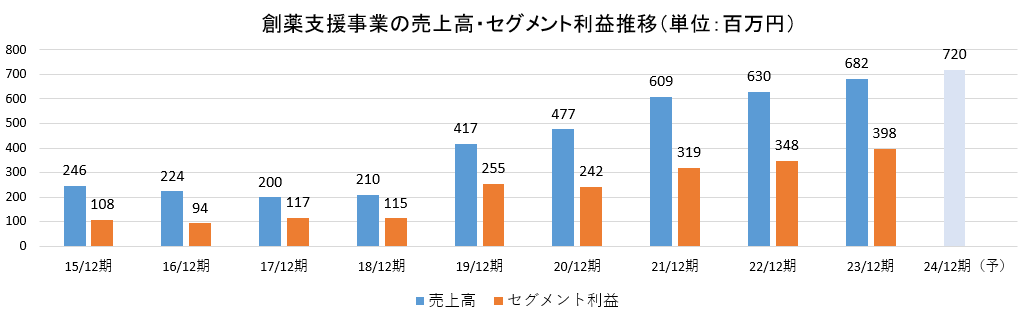
(2)創薬支援事業
製薬企業や診断薬企業、アカデミア等の研究機関で実施される創薬研究を支援するため、受託ベースで同社が保有する複数の抗体作製技術を用いた抗体作製や、抗体創薬に関連するサービスを提供し、契約一時金、マイルストーン、ロイヤルティ、受託サービス料等の対価を受け取っている。
(主なサービスの内容)
|
サービス項目 |
内容 |
| タンパク質・抗原調製、抗体の発現精製 | 抗体作製に必要な組換えタンパク質(抗原)や、研究開発用途の抗体などを細胞に発現させ、精製を行う。
種類に応じた発現・精製方法を選び、純度や物性の分析を行う。 |
| 安定発現細胞株作製 | 安定的に組換えタンパク質(抗原や抗体)を供給できるように、遺伝子組換え技術を用いて、組換えタンパク質を効率よく発現する細胞株を作製する。 |
| ADLib®システムによる抗体作製 | ADLib®システムによる抗体作製技術を用い、創薬研究に用いるモノクローナル抗体作製を行う。同社の抗体作製の知識・ノウハウを活かし、顧客のニーズに合わせた抗体作製プランを提案する。 |
| ADLib®システムを用いた抗体の親和性向上業務 | 同社が培ったADLib®システムの技術・ノウハウを活かし抗体の結合力(抗体親和性)を向上させることで、より薬効の高い抗体医薬の精製が期待できる。 |
中外製薬株式会社および同社の海外子会社であるChugai Pharmabody Research Pte. Ltd.の「中外製薬グループ」からの委託研究、小野薬品工業や協和キリンとの委託研究など、抗体医薬の研究開発を進める国内製薬企業との抗体作製プロジェクトなどを手掛けている。
|
取引先名称 |
契約締結年月 |
| ・中外製薬株式会社 | 2011年6月 |
| ・ChugaiPharmabodyResearch Pte.Ltd | 2012年8月 |
| ・田辺三菱製薬
・TANABERESEARCHLaboratoriesU.S.A., Inc. |
2016年12月 |
| ・小野薬品工業株式会社 | 2018年10月 |
| ・協和キリン株式会社 | 2019年7月 |
| ・武田薬品工業株式会社 | 2024年2月 |
創薬支援事業の販売実績のうち、中外製薬グループが占める割合が高かったため、新規顧客先開拓を課題として取り組んでいた。
2018 年5月には小野薬品工業株式会社との間で委受託基本契約を締結、また、2018年4月に取引を開始した協和発酵キリン株式会社とも、2019年7月に委受託基本契約を締結するなど、複数の抗体医薬大手の製薬企業との取引が拡大している。
19年12月期は富士レビオ株式会社から、ADLib®システムから取得した抗体を用いて開発した2製品目の診断薬キットが発売され、診断薬キットの売上に応じたロイヤルティを同社から受け取っている(ロイヤルティ受領対象期間は対象特許満了となる2023年7月28日まで)。
2022年7月には、ロート製薬株式会社との間で、ADLib®システムを用いて治療用抗体を作製する委受託契約を、2024年2月には、武田薬品工業株式会社と抗体作製技術 ADLib®システムを用いた抗体作製等に関わる業務委託基本契約締結した。
今後も同社技術の品質の高さを理解し、長期的・安定的な付き合いが可能な新規契約先獲得を目指している。
売上・利益とも堅調に拡大しており、安定した事業基盤を構築している。
(3)新規事業:バイオシミラー医薬品事業
24年6月、バイオシミラー医薬品の開発実績を有するキッズウェル・バイオ株式会社との業務提携を通じ、新たにバイオシミラー医薬品開発に参入すると発表した。
(バイオシミラー医薬品とは?)
既に承認・販売されているバイオ医薬品(先行バイオ医薬品)の特許期間・再審査期間満了後に、異なるメーカーから販売される、先行バイオ医薬品と同等/同質、安全性および有効性を有する医薬品。
分子サイズが小さく、化学合成によって先行品と完全に同一である製品を製造することが可能な「後発医薬品 (ジェネリック医薬品)」に対し、バイオ医薬品は、分子サイズが大きく、構造が複雑なため、製造業者が異なることによる製造工程の違いの影響をうけやすく、先行品と完全な同一品を製造することは困難なため、同等性/同質性を証明するために、新薬に準ずる様々な試験(品質試験、薬理試験、毒性試験、臨床試験など)が必要である。薬価は原則として先行バイオ医薬品の 70%に設定されるため、患者の経済的負担や医療費の軽減が期待される。
(キッズウェル・バイオ株式会社概要)
2001年設立。「バイオで価値を創造する-こども・家族・社会をつつむケアを目指して-」を企業理念に掲げ、既にバイオシミラー医薬品4製品を上市し安定的な収益基盤であるバイオシミラー事業と、臨床開発ステージに入り今後の飛躍的な成長基盤として期待される細胞治療事業(再生医療)を推進している。病気に苦しむ患者、特に子供たちに、革新的な治療薬・治療法を提供し、明るく幸せに暮らすことができる社会の実現に貢献すべく、日々研究開発活動に取り組んでいる。
(同事業参入の意義)
同社がこれまでに取り組んでいる新薬開発は長期にわたって研究開発投資を行うハイリスク・ハイリターン型のビジネスモデルであり、新薬開発に必要な研究開発資金を、抗体創薬プラットフォームを活かした安定的な収益を獲得する創薬支援事業とエクイティファイナンスを中心とした資金調達によって賄っている。同社の技術基盤を活かした創薬支援事業についてはこれまでに継続的にその取引規模を拡大してきたが、一方で、目下の株式市場の環境や長期金利の動向は不確実性を増しており、資金調達環境は変化している。
バイオシミラー医薬品は社会保障費の適正化と医薬品の安定供給に向けて、厚生労働省によるバイオシミラーの普及目標の設定、バイオシミラーの使用促進に向けた診療報酬の新設等、その積極的な開発と普及が期待される薬剤であり、新薬開発よりも開発投資額が抑えられ成功確度を高く見込むことができる。同社の新薬開発チームにはバイオシミラー医薬品の開発・上市経験を有するメンバーが在籍しているが、バイオシミラービジネスで既に4製品の承認品目を有するキッズウェル・バイオ社との提携によって、新たにバイオシミラー医薬品ビジネスに参入し、新薬開発と製薬会社の研究支援に続く第三の収益源創出、および社会課題の解決を行うことを目的としている。
(ビジネスモデル)
同社とキッズウェル・バイオ社が先行投資によって細胞株構築等を行った後の製剤開発ステージにおいては、導出先のパートナー企業が自ら開発を行う、もしくは、同社とキッズウェル・バイオ社が開発を受託するケースを想定している。
収益は、製剤開発スタート時の「契約一時金」、導出後の臨床試験等の進捗に伴ってその節目(マイルストーン)ごとに受領する収入である「開発マイルストン」、製品が販売(上市)された後に、その販売額の一定比率を受領する収入である「ロイヤルティ収入」となる。
【1-5 特長と強み】
(1)高い抗体開発候補品創出能力
同社では以下の3点から構成される抗体開発候補品創出能力が成長の源泉であると考えている。
①複数の抗体作製技術と技術プラットフォーム
医薬品候補抗体を継続的に創出するための独自の「ADLib®システム」をはじめとして、Tribody™、ハイブリドーマ法、DNA免疫法、細胞免疫法、タンパク質調整など、複数の抗体作製技術、タンパク質調製や抗体エンジニアリングに関する技術やノウハウ等からなる技術プラットフォームを保有している。
②医薬品候補の創製から初期臨床開発まで最速で実施できる体制
臨床開発機能を有し、自社による創薬テーマの設定から前臨床パッケージの構築、開発戦略および薬事戦略の立案、ならびにCMC開発によるCMOマネジメントなど、医薬品候補の創製から初期臨床開発までを最速で実施できる体制を確立している。
③研究開発を遂行する優秀な人材
開発メンバーの多くは上市を経験している。また、博士号を持つ研究者を多数有している。
こうした専門性の高い人材が持つネットワークを通じて、研究開発の推進に最適なリソースや資源を獲得することが可能である。
(2)創薬ビジネスにおいて独自のポジションの確立へ
大手製薬会社などは、がん領域、中枢神経領域など、領域を絞り込んで抗体作製に取り組むのが一般的である。また、国内外のバイオベンチャー等が研究開発を進めてきた開発候補品を外部から導入するケースが増えている。他方では医療用医薬品開発においてはアンメットメディカルニーズが依然として多く存在しており、今後の治療薬の開発が待たれている。
これに対し同社は、アンメットニーズで創薬の可能性のあるターゲットであれば領域を限定せず早期の段階から抗体作製に取り組み、複数の製薬会社を導出候補として医薬品のライセンスビジネスに取り組んでいる。
アンメットニーズに対する新規プロジェクトを継続的に立ち上げ、技術ポートフォリオを統合的に活用し探索プロジェクトの回転を速くすることで、できるだけ多くの開発候補品を創出するという、独自のポジションを確立しようとしている。
また、欧米では創薬のプロセスにおいてシーズを提供するアカデミアと製品化を目指すメガ・ファーマをつなぐ役割としてバイオベンチャーが重要な役割を果たしており、創薬のエコシステム(※)が機能しているが、日本では未成熟である。
同社では、抗体開発候補品創出能力の高さを武器に日本の創薬エコシステムにおいてなくてはならないポジションを確保することで勝機を見出そうとも考えている。
※エコシステム
本来の意味である生態系に端を発し、複数の企業によって構築された、製品やサービスを取り巻く共通の収益環境。この場合、欧米においては創薬に関わる全企業に収益をもたらす環境が構築されていることを意味する。
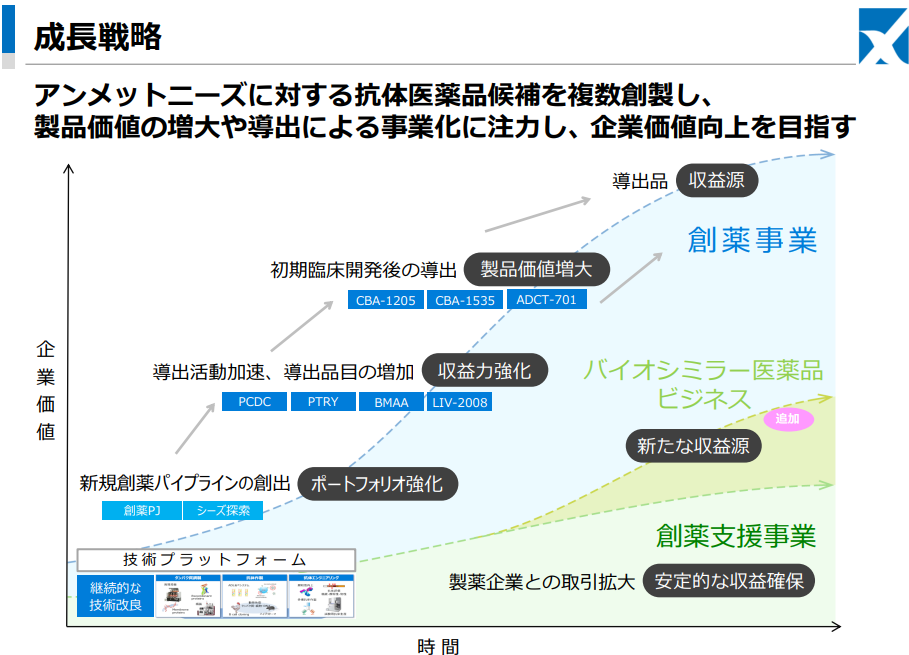
【1-6 成長戦略】
技術プラットフォームをコアとし、高品質な研究支援機能を提供する「創薬支援事業」の安定した収益の獲得をベースに、アンメットニーズに対する抗体医薬品候補を複数創製し、製品価値の増大や導出による事業化に注力する。
足元は、複数の医薬品候補の導出により投資フェーズから収益フェーズへの転換ステージにあると認識。
CBA-1205/CBA-1535/PCDCのいずれかの導出契約締結を、以降はマイルストーンを受領する導出契約を想定し、単年度黒字実現を目指している。
 |
 |
(同社資料より)
2.2024年12月期第2四半期決算概要
(1)業績概要
|
23/12期2Q |
構成比 |
24/12期2Q |
構成比 |
前期比 |
||
|
売上高 |
358 |
100.0% |
263 |
100.0% |
-95 |
-26.5% |
|
売上総利益 |
208 |
58.1% |
134 |
51.1% |
-73 |
-35.4% |
|
販管費 |
867 |
241.8% |
715 |
271.5% |
-152 |
-17.5% |
|
うち、研究開発費 |
601 |
167.7% |
446 |
169.4% |
-155 |
-25.8% |
|
営業利益 |
-659 |
– |
-581 |
– |
+78 |
– |
|
経常利益 |
-662 |
– |
-563 |
– |
+98 |
– |
|
当期純利益 |
-663 |
– |
-563 |
– |
+99 |
– |
*単位:百万円
増収、損失幅縮小
売上高は前年同期比95百万円減の2億63百万円。創薬支援事業において一部新規案件の検収時期の後ズレや顧客内の組織変更の影響を受けた。営業損失は同78百万円縮小の5億81百万円。研究開発費が同1億55百万円減少。これは主にCMC費用が前年同期よりも減少したことによるもの。
(2)セグメント別動向
|
|
23/12期2Q |
24/12期2Q |
前年同期比 |
|
|
創薬事業 |
– |
– |
– |
– |
|
創薬支援事業 |
358 |
263 |
-95 |
-26.5% |
|
連結売上高 |
358 |
263 |
-95 |
-26.5% |
|
創薬事業 |
-601 |
-446 |
+155 |
– |
|
創薬支援事業 |
+208 |
+134 |
-73 |
-35.4% |
|
調整額 |
-266 |
-269 |
-3 |
– |
|
連結営業利益 |
-659 |
-581 |
+78 |
– |
*単位:百万円。調整額は決算短信よりインベストメントブリッジが計算。
創薬支援事業の売上高は前年同期比95百万円減の2億63百万円。一部新規案件の検収時期の後ズレや顧客内の組織変更の影響を受けた。
営業利益は同73百万円減の1億34百万円。受託事業の拡大を見越した設備投資を行った。
減収減益とはなったが、抗体創薬の技術・サービスが有用との評価を得ており、既存顧客との取引は安定的に推移している。
今上期には新たに武田薬品と業務委託基本契約を締結するなど、新規顧客開拓も進んでいる。
(3)財政状態と
キャッシュ・フロー
◎主要BS
|
23/12末 |
24/6末 |
増減 |
23/12末 |
24/6末 |
増減 |
||
|
流動資産 |
1,629 |
1,421 |
-207 |
流動負債 |
539 |
432 |
-107 |
|
現預金 |
1,325 |
1,103 |
-221 |
短期借入金 |
291 |
292 |
+1 |
|
売掛金 |
83 |
50 |
-32 |
固定負債 |
54 |
54 |
0 |
|
固定資産 |
122 |
136 |
+13 |
負債合計 |
593 |
486 |
-106 |
|
有形固定資産 |
1 |
0 |
0 |
純資産 |
1,157 |
1,070 |
-87 |
|
投資その他の資産 |
120 |
135 |
+14 |
利益剰余金 |
-5,236 |
-563 |
+4,672 |
|
資産合計 |
1,751 |
1,557 |
-194 |
負債純資産 |
1,751 |
1,557 |
-194 |
*単位:百万円
現預金の減少などで資産合計は前期比1億94百万円減の15億57百万円。
未払金の減少などで負債合計は同1億6百万円減の4億86百万円。
減資により資本金・資本準備金が減少した一方、利益剰余金が増加し、純資産は同87百万円減少し10億70百万円。
自己資本比率は前期末から2.9ポイント上昇して68.0%となった。
◎キャッシュ・フロー
|
23/12期2Q |
24/12期2Q |
増減 |
|
|
営業CF |
-595 |
-677 |
-82 |
|
投資CF |
0 |
– |
0 |
|
フリーCF |
-595 |
-677 |
-82 |
|
財務CF |
113 |
455 |
+342 |
|
現金及び現金同等物 |
1,245 |
1,103 |
-141 |
*単位:百万円
キャッシュポジションは低下した。
(4)トピックス
①創薬事業
詳細は【1-4 事業内容】パイプラインおよび開発状況を参照。
*CBA-1205
臨床第1相試験前半パートで登録されたメラノーマ(悪性度の高い皮膚がんの一種)の患者で腫瘍縮小を伴うSD(安定)評価が続き36ヶ月を超えて長期継続投与中である。
メラノーマへの本剤の開発可能性について治験責任医師と科学的な検討を行っている。
*CBA-1535
固形がんの患者を対象に段階的に用量を上げながら、安全性と本剤のコンセプトであるT細胞の活性化、初期の有効性を評価中で、現時点では軽微な副作用のみ確認され、安全性を懸念するデータは無い。
*ADCT-701
米国国立がん研究所(NCI)が神経内分泌がんを対象とした第1相試験を開始し、2024年7月に第1例目被験者への投与が行われた。
*創薬プロジェクト
前臨床段階にある複数の創薬プロジェクトの導出活動を継続している。今期中の導出に向けて秘密保持契約下での協議、MTA評価や経済条件の交渉等を進めている。
②創薬支援事業
武田薬品工業株式会社と業務委託基本契約を締結した。
3.2024年12月期の見通し
創薬事業における合理的な業績予想の算定が困難なため、2024年12月期の業績予想は創薬支援事業の売上高720百万円のみ開示している。
(1)創薬事業
①CBA-1205及びCBA-1535の臨床試験の着実な進展を目指す。
*CBA-1205
第I相試験は前半パートを終え後半パートへ移行し、2025年に終了する予定。
今後の導出活動において重要となる肝細胞がん患者での安全性及び初期の有効性の評価を進める。加えて、適応症拡大に向けて動物モデルにおける薬効データの確認を進めるほか、バイオマーカー探索など製品価値の向上に向けた基礎研究を推進する。
*CBA-1535
第1相試験の前半パートでは単剤での安全性および初期の有効性の評価を進める。
②前臨床段階にあるPCDCについては、製薬企業からADC用途の抗体としての期待があることから積極的に導出機会を捉えていく。
探索研究段階にある創薬プロジェクトについては3つ目の臨床開発品目創出または早期導出を目指して研究を推進する。
(2)創薬支援事業
売上高は前期比5.6%増の7億20百万円を見込んでいる。
既存顧客ニーズに対して丁寧に対応するとともに、製薬企業等からの新規抗体作製やタンパク質調製等の受託業務を拡大する。
引き続き、武田薬品工業も加わった既存大口顧客との継続的なビジネスを確固たるものとする。
新たな取引先の開拓と着実な収益拡大を目指す。
前期締結した国内大手製薬企業、国内診断薬企業、国立研究開発法人との新規契約は、今期以降の収益に寄与すると期待している。
4.今後の注目点
同社では、今来期、CBA-1205、CBA-1535、PCDCいずれかの導出契約締結を、以降は、マイルストーンを受領する導出契約を想定している。堅調に拡大を続ける創薬支援事業に加え、新たにバイオシミラー医薬品事業にも参入した。早期の黒字化、収益拡大を引き続き期待したい。
<参考:コーポレートガバナンスについて>
◎組織形態、取締役、監査役の構成
|
組織形態 |
監査役設置会社 |
|
取締役 |
5名、うち社外1名(うち独立役員1名) |
|
監査役 |
3名、うち社外2名(うち独立役員1名) |
◎コーポレートガバナンス報告書
最終更新日:2024年8月14日
<基本的な考え方>
当社は、ライフサイエンスを通じて持続的な成長と企業価値の向上を図るとともに、株主、顧客をはじめ、取引先、研究パートナー、地域社会、従業員等の全てのステークホルダーに対してフェアな企業であることを目指しております。そのためには、コンプライアンスの徹底、経営活動の透明性の向上、責任の明確化に努めていくことを重要な課題と捉え、コーポレートガバナンスの継続的な充実に取り組んでまいります。
<コーポレートガバナンス・コードの各原則を実施しない理由>
当社はコーポレートガバナンス・コードの【基本原則】をすべて実施しております。

