(2183)株式会社リニカル 減収減益 大口案件の受託獲得へ
 秦野 和浩 社長 |
株式会社リニカル(2183) |
 |
会社情報
|
市場 |
東証1部 |
|
業種 |
サービス業 |
|
代表取締役社長 |
秦野 和浩 |
|
所在地 |
大阪市淀川区宮原 1-6-1 新大阪ブリックビル |
|
決算月 |
3月 |
|
HP |
株式情報
|
株価 |
発行済株式数(自己株式を控除) |
時価総額 |
ROE(実) |
売買単位 |
|
|
892円 |
22,586,436株 |
20,147百万円 |
9.8% |
100株 |
|
|
DPS(予) |
配当利回り(予) |
EPS(予) |
PER(予) |
BPS(実) |
PBR(実) |
|
14.00円 |
1.6% |
-円 |
-倍 |
252.92円 |
3.5倍 |
*株価は7/1終値。発行済株式数は直近四半期末の発行済株式数から自己株式を控除。
*ROEは21/3月期。DPSは22/3月期予想。EPSは非公表。数値は四捨五入。
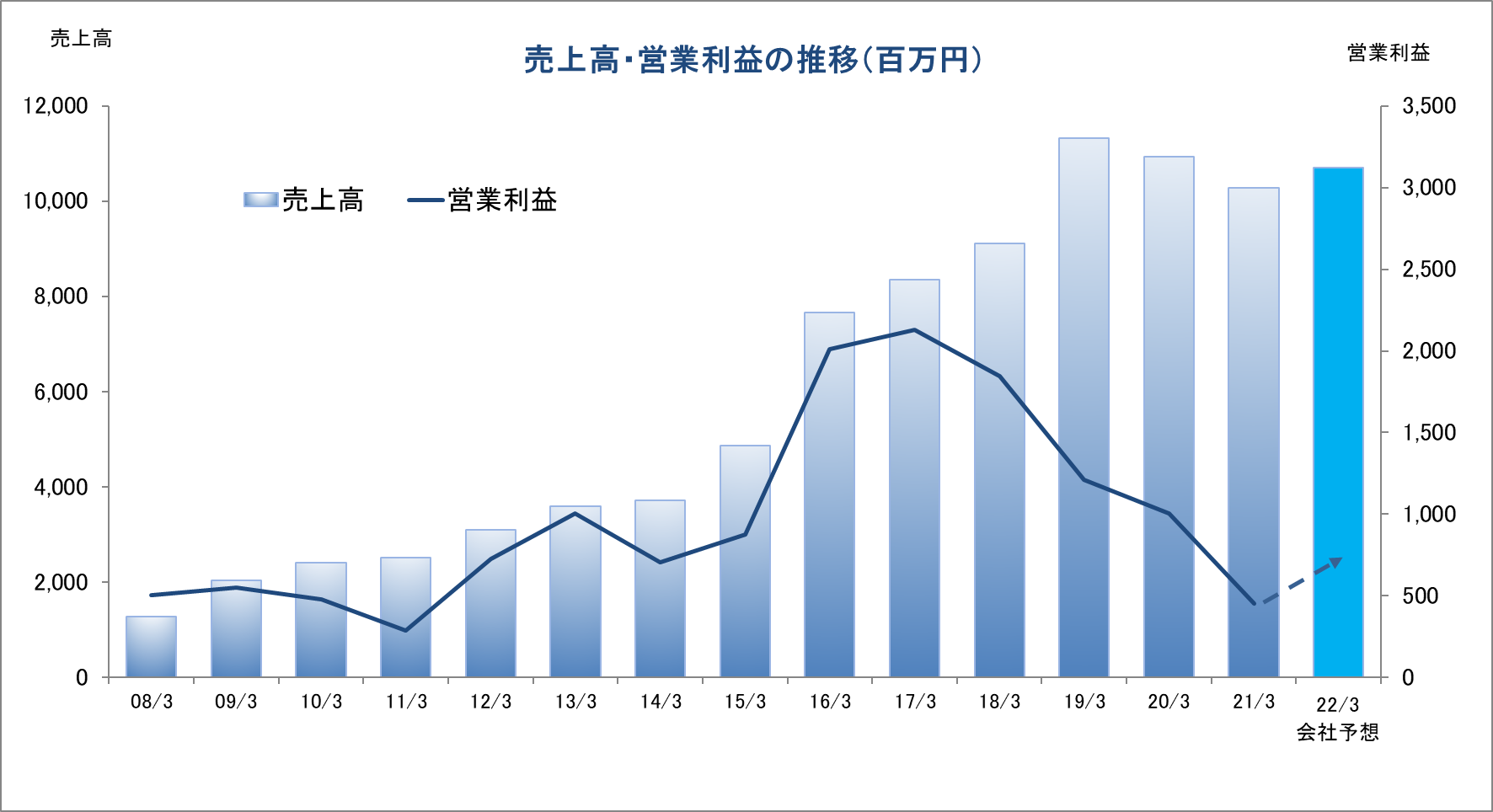
連結業績推移
|
決算期 |
売上高 |
営業利益 |
経常利益 |
親会社株主帰属利益 |
EPS |
DPS |
|
2018年3月(実) |
9,113 |
1,846 |
1,826 |
1,295 |
57.02 |
11.00 |
|
2019年3月(実) |
11,313 |
1,212 |
1,253 |
568 |
25.09 |
12.00 |
|
2020年3月(実) |
10,935 |
1,005 |
918 |
482 |
21.38 |
14.00 |
|
2021年3月(実) |
10,279 |
453 |
588 |
539 |
23.91 |
14.00 |
|
2022年3月(予) |
10,700 |
683 |
– |
– |
– |
14.00 |
*予想は会社予想。
*経常利益と親会社株主に帰属する当期純利益の連結業績予想は、為替相場の変動など未確定な要素が多く非公表。
リニカルの2021年3月期について、ブリッジレポートにてご報告致します。
目次
今回のポイント
1.会社概要
2.経営戦略
3.2021年3月期決算
4.2022年3月期業績予想
5.今後の注目点
<参考:コーポレート・ガバナンスについて>
今回のポイント
- 21/3期は前期比6.0%の減収、同54.9%営業減益。米国においては、治験業務に関してリモートでの治験実施を可能とする制度対応が取られる中、米国子会社がこれらに迅速に対応したことで、前期比で売上高が増加し、のれん償却費控除後の営業利益が黒字化した。一方、世界的な新型コロナウイルス感染症拡大の影響を受け、医療機関への訪問規制などにより一部治験業務の実施が困難となったことや開発案件の絞り込みなど製薬会社の開発計画の修正の影響を受けたことなどにより日本や欧州で減収減益となった。
- 22/3期の会社計画は、前期比4.1%の増収、同50.6%の営業増益の予想。日本・アジア地域を中心に製薬会社が新型コロナウイルス感染症収束後を見越して一時凍結等していた研究開発投資を再始動しており、直近で日亜米欧のグローバル試験で受注内定を受けた他、新規案件の引き合いが増加している。こうした中、各地域の新型コロナウイルス感染症の流行状況やワクチン接種状況を踏まえ、米国は第2四半期、欧州は第3四半期、日本・ アジアは第4四半期からの業績正常化を前提としている。配当は前期と同額の1株当たり普通配当14円の予想。
- 18年ぶりに米国でアルツハイマー型認知症(AD)の新薬がFDAで承認された。疾患修飾療法としては世界初となる。同社はこれまでにアルツハイマー型認知症(AD)薬の臨床試験を複数受託しており、この分野においても既にノウハウを蓄積している。今後拡大が予想されるアルツハイマー型認知症(AD)分野において臨床試験の大口案件の受託を獲得できるのか注目される。
1.会社概要
臨床試験(治験)に関わる業務の一部を代行する事で製薬会社の医薬品開発を支援するCRO(Contract Research Organization)事業を中心に、医薬品のマーケティング業務ならびに製造販売後(以下製販後という)臨床研究・調査の受託などを行う育薬事業を手掛ける。
医薬品は発売前に厚生労働省の承認・認可を受けることが義務づけられており、承認前の薬剤(医薬品候補)を患者に投与して効果や安全性を確かめる必要がある。その臨床試験としての治験を支援する事業がCRO(Contract Research Organization)である。また、医薬品は製販後も調査、臨床研究を行う必要があり、その段階を支援する事業が育薬(Contract Medical Affairs)である。
同社は創業以来、がん・中枢神経系(CNS)など、世界中の人々がその撲滅を願い、新薬開発への強いニーズが存在する疾病領域を中心にCRO事業を展開してきた。これらは非常に難易度が高い領域であり、同社の知識・経験豊富なエキスパートが高度な治験を支えている。また、同社は創薬支援・育薬事業にも力を注ぎ、申請業務支援、承認後のマーケティングや臨床研究、製販後調査支援まで、単なるアウトソーシングを越えてお客様の事業を幅広くコンサルティングする「製薬会社の真のClinical Development Partner(医薬品開発パートナー)」を目指している。更に、国際化・大規模化が進む医薬品開発の流れのなかで、グローバルで大規模なプロジェクトにも同社グループのワンストップで十分な対応を行い、製薬会社とともに新しい時代を開拓していく戦略的ビジネスパートナーとして、顧客の市場競争力の拡充をトータルに支援している。
また、同社は、受託特化型の事業形態により、特定業務への特化(治験の主要業務であるモニタリング業務、品質管理業務、コンサルティング業務)、特定治験段階への特化(フェーズⅡ、フェーズⅢ)、特定顧客への特化(豊富な医療品開発情報を有する大手製薬会社)を通じて、高収益体質を構築している。
【沿革】
2005年6月、藤沢薬品工業株式会社(現 アステラス製薬株式会社)で免疫抑制剤等の開発に携わってきたメンバー9名によって設立された。大阪発理想の医薬品開発受託(CRO)事業を目的として、設立当初から、CNS領域やがん領域の育成に取り組み、会社設立後まもなく大塚製薬からCNS領域の案件を受注。その後、人材を補強し事業部として受注活動を強化した。また、がん領域も外資系製薬会社等でがん領域の医薬品開発を手掛けた人材等に恵まれ、足元、受注が拡大している。
SMO(治験施設支援機関)事業進出を念頭に、06年1月に同事業を手掛けるアウローラ(株)を子会社化したが、CRO事業への経営資源集中を図るべく07年5月に全保有株式を売却。08年7月に、国内の製薬会社の米国進出支援を目的に米国カリフォルニア州に全額出資子会社LINICAL USA, INC.を設立。同年10月の東証マザーズ上場を経て、13年3月に東証1部に市場変更となった。13年5月に、台湾と韓国に全額出資子会社LINICAL TAIWAN CO.,LTD.とLINICAL KOREA CO.,LTD.を設立。14年4月には、LINICAL KOREA CO.,LTD.と買収した韓国のCROであるP-pro. Korea Co., Ltd.との統合を完了した。14年10月29日には欧州でCRO事業を展開しているNuvisan CDD Holding GmbHの全株式を取得し子会社化するための株式譲渡契約を、Nuvisan Pharma Holding GmbH との間で締結し、12月1日付けで同社の100%子会社となった。更に、グループとしての一体感の醸成と連携強化を図るため、連結子会社となったNuvisan CDD Germany GmbHの名称をLINICAL Europe GmbHに商号変更した。その他、16年3月にLINICAL U.K. LTD.を、同年10月にLINICAL POLAND Sp.z.o.o.を、17年9月にLINICAL Czech Republic s.r.oを 設立した。また、2018年4月に米国でAccelovance,Inc.を買収し、Linical Accelovance America,Inc.に社名変更。その他、19年3月にLinical Hungary Kft.を設立、19年5月にLinical China Co., Ltd.を設立した。更に、2019年12月にLINICAL Europe GmbHへLAA社の欧州子会社を統合し欧州地域の強化を図ったことに加え、20年2月に上海支店を開設し国際共同治験の受託体制が更に強化された。また、20年4月にLinical Benelux B.V と Linical Accelovance Europe B.V. を合 併し、Linical Netherlands B.Vを発足、21年にはLinical China Co., Ltd. とLinical Accelovance China Ltd.の統合を予定している。
【業務内容】
同社は、主にCRO事業(臨床開発事業)、製造販売後の臨床試験や臨床研究とマーケティング活動支援を担当する育薬事業、創薬支援事業を展開している。非臨床試験段階から臨床開発、製造販売後の育薬まで一気通貫で対応出来る体制をとることで、効率的な新薬開発による上市までの期間の短縮や製品ライフサイクルの延長を可能とし、製薬会社の真のパートナーとして医薬品の価値最大化に貢献している。更に、同社は、製薬会社のみならずバイオベンチャーに対して、ライセンス等の出口戦略まで多面的に支援している。
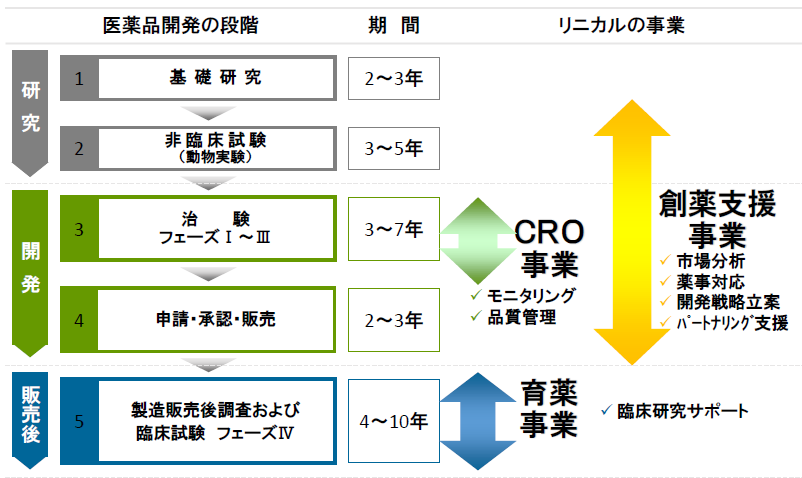
(同社決算説明会資料より)
CRO事業(臨床開発事業)
主力のCRO事業においては、事業特化型CROに特徴がある。新薬の迅速な市場投入につながる高品質で高効率な治験の支援を目指して、高い技術と豊富な経験をもつスタッフが担当にあたっている。今後も拡大するグローバルスタディに対応していくため、アジア(韓国、台湾、シンガポール、中国など)と欧州、米国に拠点を開設。薬事から企画、実施計画書の作成、モニタリング、データマネージメント、統計解析、ファーマコビジランスまでワンストップで対応。国際共同治験においては、リニカル本社を窓口に位置づけ、各国に医薬品開発事情に精通した人材を配置。日本語ベースで機動的な国際共同治験が可能な開発環境を整えている。10年から20年近くに及ぶ新薬開発プロジェクトの中でも、3年から7年を要するといわれる治験で特に重要とされる患者を対象とする「第Ⅱ相(フェーズⅡ試験)」「第Ⅲ相(フェーズⅢ試験)」のプロセスに特化し、受託特化型の事業形態にて治験の核となる「モニタリング」を「品質管理」「コンサルティング」とともに提供。信頼性の高いデータの収集を行い、迅速、確実な新薬開発の実現を支援している。更に、豊富な医薬品開発情報を有する大手製薬会社に特化すると共に、担当領域も市場からの開発要請の強いがん領域や中枢神経系領域をはじめ難易度の高い領域に特化することで、顧客である製薬会社のニーズに応えている。
また、同社は、スケジュール管理、治験標準業務手順書・GCP遵守、データ・症例報告書の信頼性などの分野におけるサービスクオリティの高さに強みを持っている。
*国際共同治験
「国際共同治験」とは、新規の医薬品開発に世界規模で取り組み、早期上市を目指すため、臨床試験を複数の国または地域において同時並行的に行うことをいう。
*GCP(Good Clinical Practice)
「GCP」とは治験を実施する際に守るべきルールで、日本で正しく治験を実施できるように厚生労働省により省令(法律を補う規則)として定められているもの。
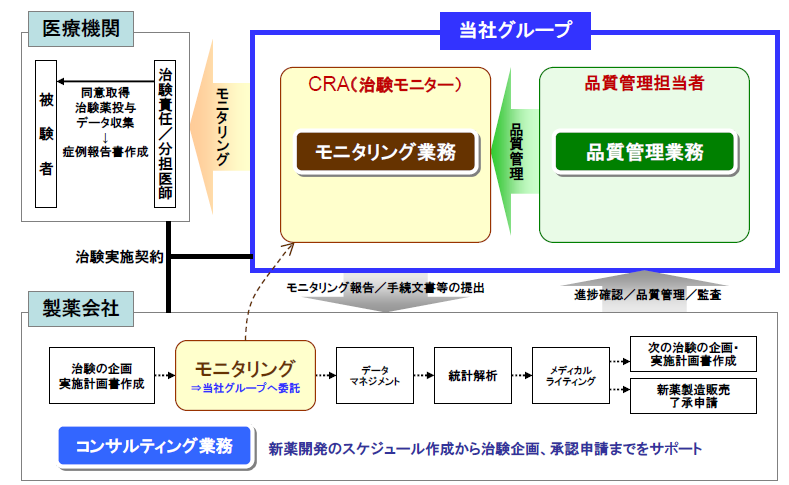
(同社決算説明会資料より)
育薬事業
臨床研究法が施行され臨床研究を取り巻く環境は大きく変化している中、情報をタイムリーにキャッチアップし、製薬会社のメディカルアフェアーズ部にとって最良のパートナーとなれるよう、臨床研究のモニタリング・研究事務局業務を中心にデータマネジメント・統計解析などを含めたフルサービスの支援を行っている。J-GCPだけでなく、倫理指針、臨床研究法に加えてICH-GCP準拠の臨床試験も対応しており、全てのレギュレーションでのサービスを提供している。また、当初よりPrimary領域、中枢神経領域でのサービスを提供。現在はがん領域を強化し、半数以上のモニターががん領域の経験者となっている。開発で培ったノウハウをベースに、最新のレギュレーションに対応し、難易度の高い領域でエビデンス創造に貢献する方針。
創薬支援事業
既存の臨床開発事業と育薬事業に続く、第3の事業である創薬支援事業 (Innovative Drug Development Business) を展開中。国内大手製薬会社でライセンス、事業開発、臨床開発、開発薬事、マーケティングといった業務に携わり、開発品の目利きから、導入・導出交渉、臨床開発などで数々の実績と豊富な経験を有している担当者が中心となり、主に①開発品の市場分析、②薬事相談のサポート、③ライセンスのサポートの3種のコンサルティングサービスを提供している。これらの経験を武器に、現在、国内または国外の製薬会社、バイオテクノロジーカンパニーからの業務を開発早期より支援している。今後、更に同社の国際拠点と連携し、グローバルでトータルにサポートできる体制を進める方針。
【5つの強み】
(1)グローバル規模でワンストップ
同社は日本発のグローバルCROとして、日本を中心にアジア、欧州、米国の3極でサービスを提供可能であり、同社として20ヶ国程度、パートナーを通じてサービスを提供出来る国を含めると30ヶ国程度においてサービスの提供が可能。また、医薬品開発のプランニングから、モニタリング、データマネジメント、統計解析、メディカル・ライティング、薬事、ファーマコ・ビジランスなどあらゆるサービスにおいて経験豊富なプロフェッショナル・メンバーが顧客ニーズに応え、Local試験はもちろん、マルチナショナル・トライアルまでフルサービス、且つ、ワンストップで提供している。
LINICAL Global 拠点 「日本・アジア+米国+欧州」の3極体制」
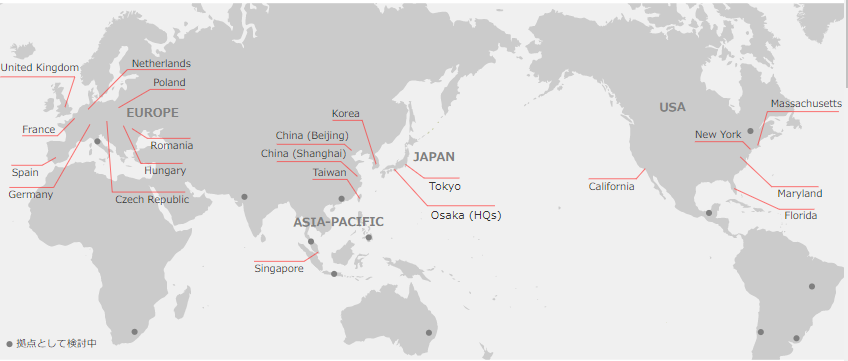
(同社ホームページより)
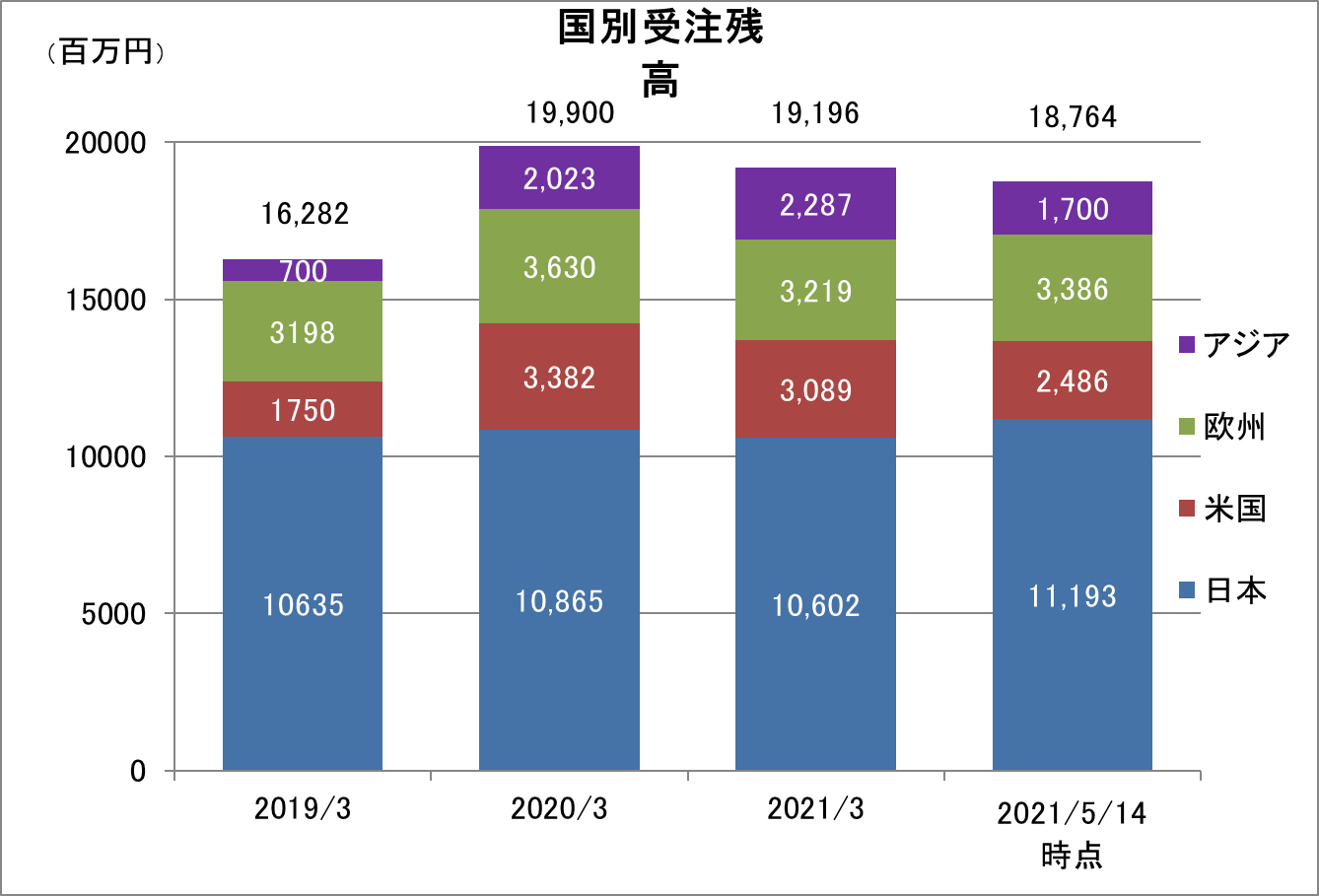
新型コロナウイルス感染症拡大の影響があるものの、日本・アジア+米国+欧州の3極体制整備の成果により、いずれの地域においても高水準の受注残高を維持している。また、2021年5月14日時点の受注残高は、21/3期末より減少しているものの、契約締結作業中の日本・アジア、欧州、米国の大型案件を加えると、実質的な受注残高は、200億円を超える水準となっている模様である。
(2)創薬支援から臨床開発、臨床研究まで
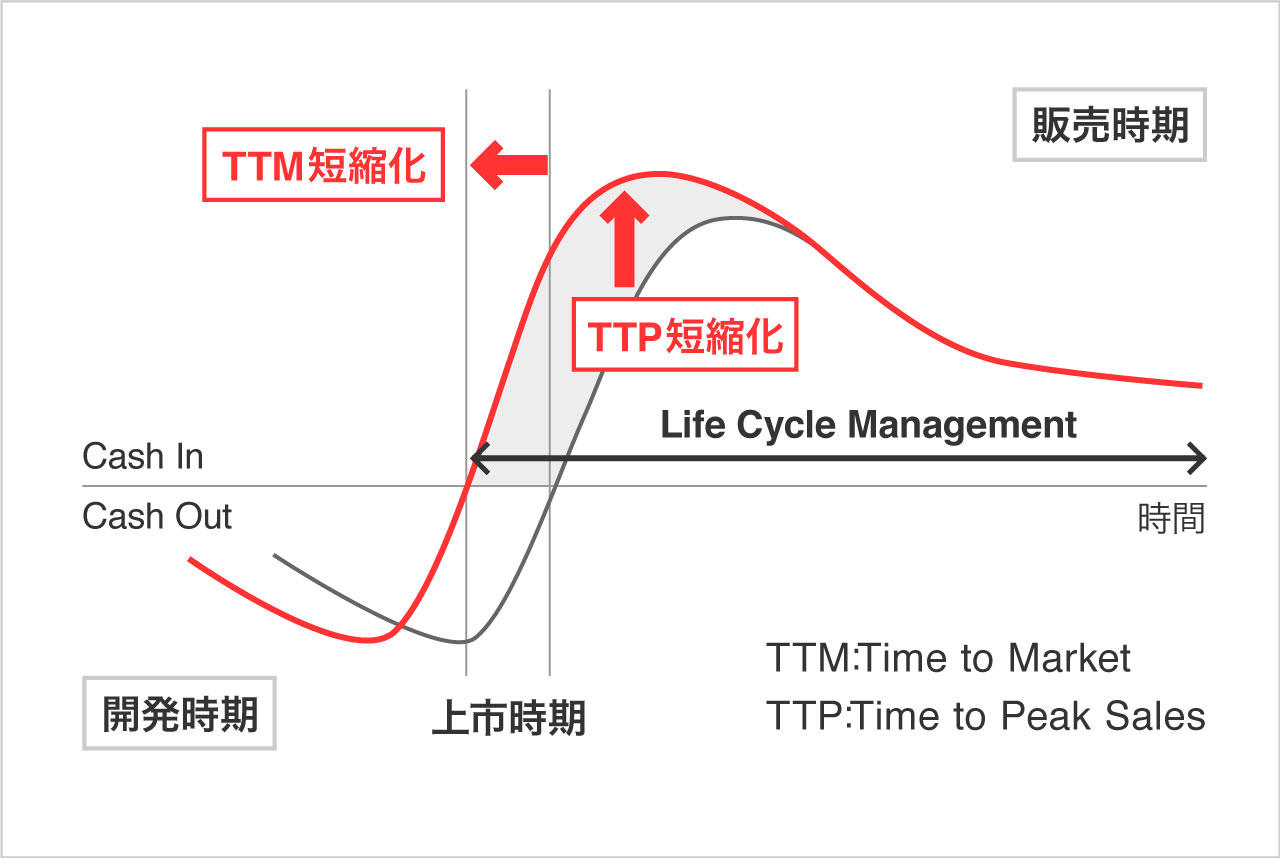
同社はCSR(corporate social responsibility)として、医薬品開発業務の一端を担う会社として社会に貢献したいと考えている。更に、同社は顧客の真のパートナーとして薬剤の価値最大化に貢献するべく、創薬段階から臨床開発、製造販売後の育薬まで一気通貫で対応出来る体制をとることにより、効率的な新薬開発とライフサイクルマネジメントの延長を可能とし、上市までの期間の短縮(TTM)と売上の早期最大化(TTP)を図っている。日本においては創薬支援事業で創薬支援を、臨床開発事業(CRO事業)では臨床開発を、臨床研究支援事業では製造販売後の臨床試験や臨床研究をサポートしている。
(同社HPより)
(3)がん・中枢・免疫にフォーカス
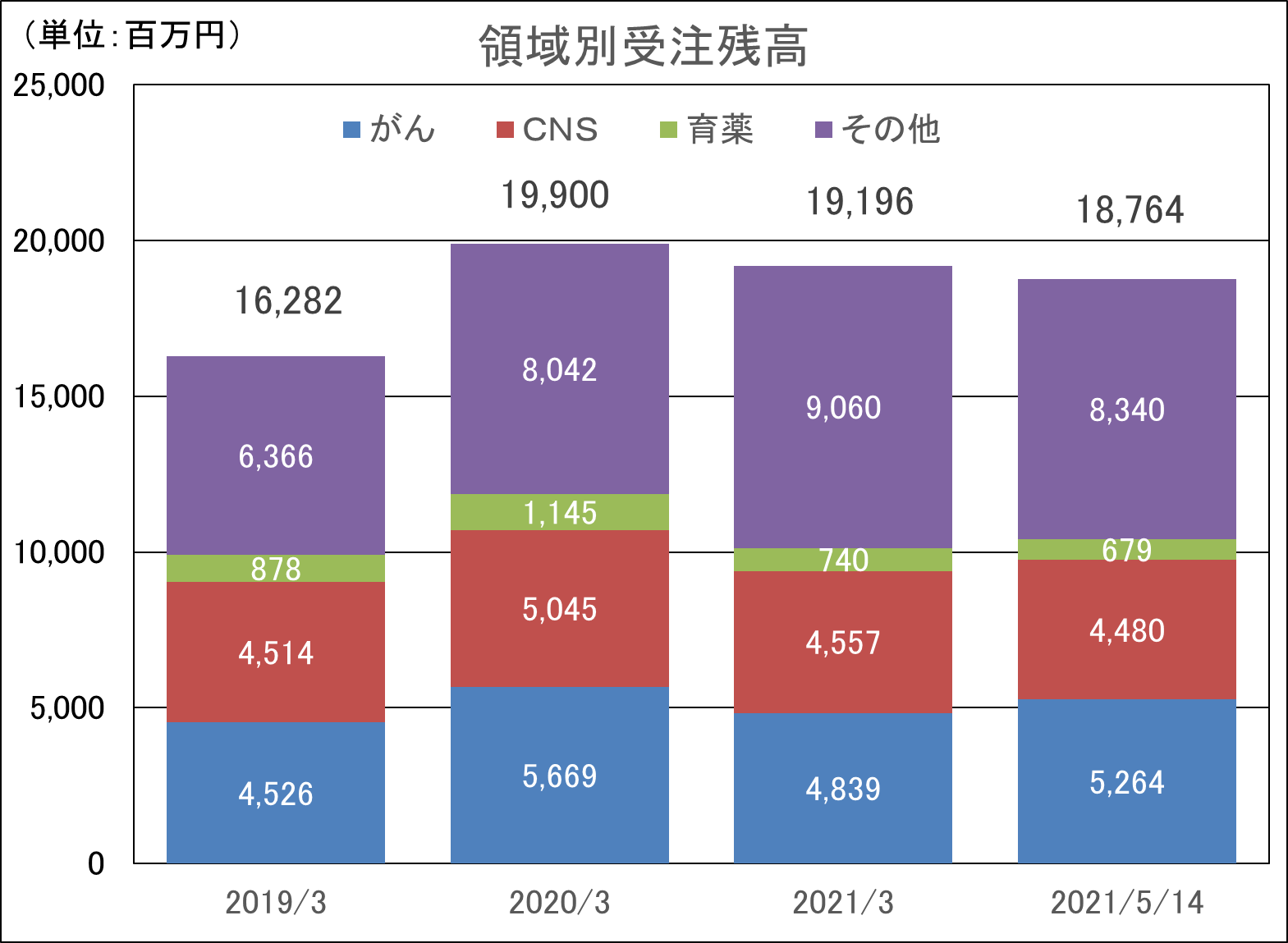
医薬品開発のトレンドは、がん、中枢神経系、免疫領域に集中してきている。同社創業メンバーは免疫領域において豊富な経験を持ち、創業当初より難易度の高い免疫領域等を中心にサービスを提供してきた。その後、日本においては2006年に中枢神経領域、2010年にがん領域へと専門性を拡げていき、現在では難易度の高い、がん、中枢神経系、免疫などアンメット・メディカル・ニーズな領域でのサービスを大きな3本柱として事業を展開している。また、海外子会社においても同じく、がん、中枢神経系、免疫系のサービス実績が多く、同社全体で難易度の高いがん、中枢神経系、免疫系を得意領域としている。更に、今後成長が見込まれる皮膚科領域や眼科領域に加え、難易度の高い再生医療領域も今後のサービスの大きな柱にするべく、準備を進めている。
(同社決算説明資料より)
新型コロナウイルス感染症拡大の影響があるものの、受注を順調に消化しつつ新規の受注を獲得し、受注残高はCNS領域(中枢神経系)、がん領域を中心に高水準を維持している。
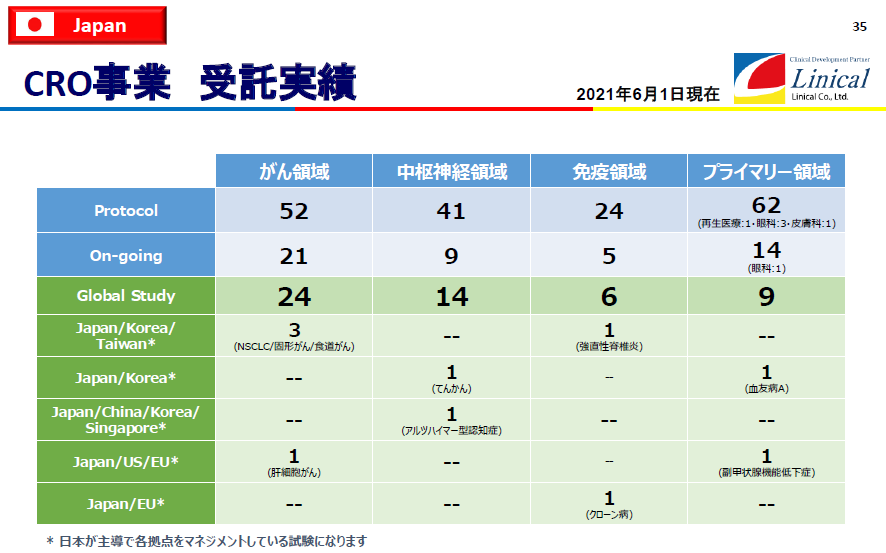
受託試験実績(2021年6月1日現在)
(同社決算説明会資料より)
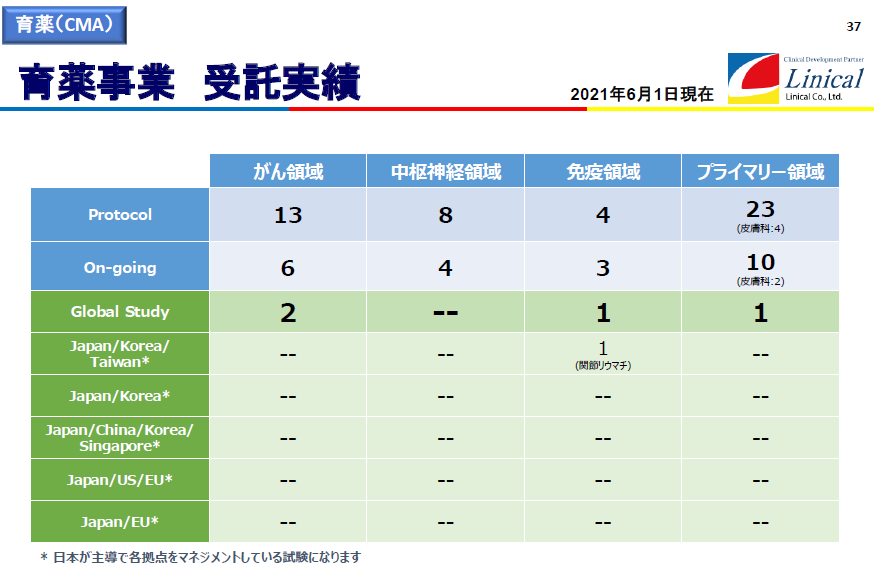
(同社決算説明会資料より)
(4)グローバル・コラボレーション
日本発グローバルCROとして、顧客へ世界規模のサービスを提供。高品質(Japan Quality)なサービスを提供する為に、日本に国際事業開発本部を設置し、日本語、英語、母国語を含めたその他言語(韓国語、中国語、ドイツ語など)が堪能なマルチリンガル・メンバーを大阪本社および東京支社に多数配置し、海外メンバーと適切なコミュニケーションをとっている。日本の顧客とは日本語でのコミュニケーションも可能。海外メンバーもJapan Qualityについて理解を深めており、All LinicalとしてJapan Qualityを提供している。
日本発の日台韓Asia試験の実施体制の一例として、日本にProject Managerを配置し、日台韓のLeaderを日本に配置するケース、各国拠点にLeaderを配置するケースなど、顧客ニーズに沿った提案があげられる。また、日本発の日米試験やEUとAsia、EUと米国との共同試験も多数実績があり、顧客の開発戦略に合わせた世界規模での提案が可能。
(5)高品質なサービス
同社は顧客へ高品質なサービスを提供すべく、社員に対して量・質ともに充実した教育を実施。その成果として、一般社団法人日本臨床試験学会によるGCPサポート認定試験にて第1回目から高い合格率を維持しており、当学会より高い合格率と質の高い臨床試験の推進に貢献した証として感謝状を授与された。また、GCP適合性調査の経験が豊富にあり、FDA inspectionの経験もある。いずれも適合・問題無しとの評価を受けており、同社の品質については社外からも高い評価を得ている。なお、海外子会社においても、FDAやKFDA 、ANVISAなどからのinspectionの経験があり、日本同様に高い評価を得ている。同社は、高品質とスピードを両立して最高のサービスを顧客に提供することが最大の使命と強く認識している。
2.経営戦略
【第1目標】
①日本・アジア、欧州、米国での拠点整備、1000 人体制の構築
②各極の黒字化
③世界20ヵ国程度への進出
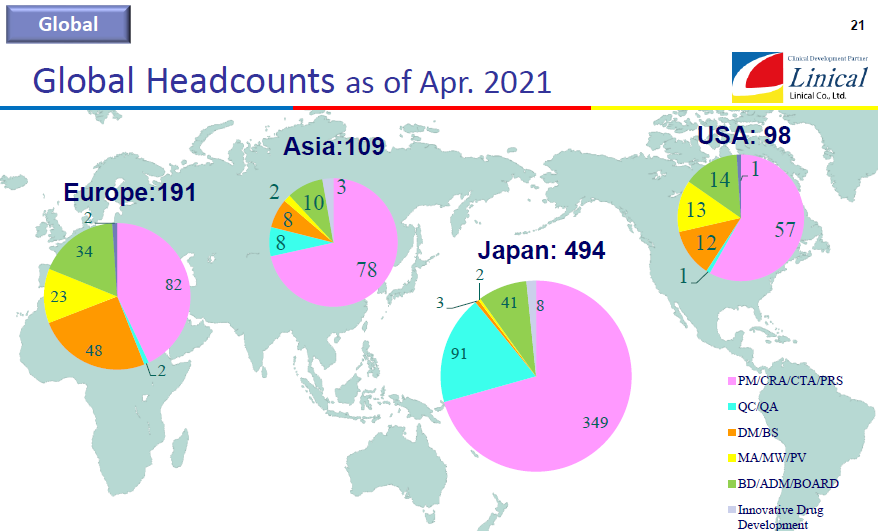
(同社決算説明会資料より)
【第2目標】
①日本500人、アジア400人、欧州400人、米国400、1500人を超える体制の構築
②各極で成長投資(M&Aを含む)を行いつつ黒字維持、利益率の向上
③世界60ヵ国程度への進出
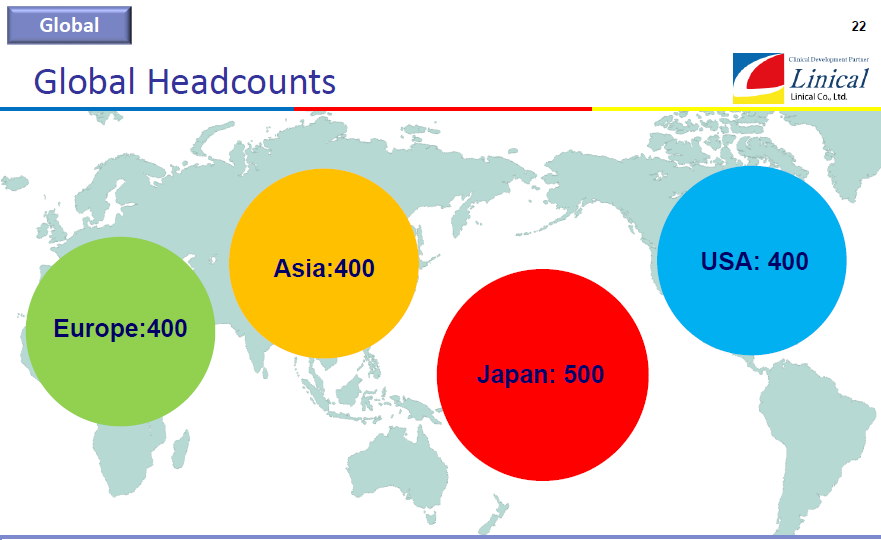
(同社決算説明会資料より)
(1)日本の戦略
【CRO事業】
|
初期 |
現在 |
|
| 顧客 | 国内大手製薬会社 | 国内大手製薬会社
海外大手製薬会社 国内外のバイオベンチャー |
| 疾患領域 | がん領域
CNS領域 免疫領域
|
がん領域
CNS領域 免疫領域 眼科領域 皮膚科領域 再生医療 |
| サービス | モニタリング | モニタリングプロジェクトマネジメント
品質管理/監査 データマネージメント メディカルライディング ファーマコビジランス など |
(同社決算説明会資料より)
従来は、国内大手製薬会社が中心であったが、フルサービスの提供を通じて海外大手製薬会社や国内外のバイオベンチャーにおけるシェアアップを図る。また、がん領域、CNS領域、免疫領域に加え、再生医療、皮膚科、眼科領域に本格的に進出する。
【育薬事業】
臨床研究法が施行され臨床研究を取り巻く環境は大きく変化しており、情報をタイムリーにキャッチアップし、製薬会社のメディカルアフェアーズ部にとって最良のパートナーとなれるよう、臨床研究のモニタリング・研究事務局業務を中心にデータマネジメント・統計解析などを含めたフルサービスの支援を行っている。J-GCPだけでなく、倫理指針、臨床研究法に加えてICH-GCP準拠の臨床試験も対応しており、全てのレギュレーションでのサービスの提供が可能である。また、当初よりPrimary領域、中枢神経領域でのサービスを提供していたものの、現在はがん領域を強化し、半数以上のモニターががん領域の経験者である。今後も開発で培ったノウハウをベースに、最新のレギュレーションに対応し、難易度の高い領域でエビデンス創造に貢献する方針である。
育薬事業の業績推移
|
12/3期 |
13/3期 |
14/3期 |
15/3期 |
16/3期 |
17/3期 |
18/3期 |
19/3期 |
20/3期 |
21/3期 |
|
|
売上高 |
138,400 |
169,226 |
288,205 |
364,918 |
553,399 |
806,764 |
908,810 |
954,438 |
1,032,353 |
949,335 |
|
営業利益 |
-21,016 |
19,504 |
68,010 |
111,006 |
208,284 |
293,028 |
277,848 |
263,702 |
368,393 |
247,600 |
*単位:千円
(注)16/3期第1四半期連結会計期間より従来のセグメントの名称を「CSO事業」から「育薬事業」へ変更した。
【創薬支援事業】
同社は、既存の臨床開発事業と育薬事業に続く、第3の事業である創薬支援事業 (Innovative Drug Development Business) を展開している。国内大手製薬会社でライセンス、事業開発、臨床開発、開発薬事、マーケティングといった業務に携わり、開発品の目利きから、導入・導出交渉、臨床開発などで数々の実績と豊富な経験をしている人材が中心となり、主に①開発品の市場分析、②薬事相談のサポート、③ライセンスのサポートの3種のコンサルティングサービスを提供している。
それらの経験をもとに、現在、日本、韓国、台湾の製薬会社、バイオテクノロジーカンパニーからの業務を開発早期より支援しており、今後、更に同社の国際拠点と連携し、グローバルでトータルにサポートできる体制を推進する方針である。
創薬支援事業 -3種のコンサルティング-
|
市場分析/調査 |
・対象疾患の疫学調査
・市場価値と動向予測 ・現行治療アルゴリズムとガイドライン調査 ・承認薬と開発パイプライン調査 ・目標とする製品性能(TPP)立案 ・公定薬価とピークセールス予測、収益性評価 |
|
薬事・ 開発戦略 PMDA相談 (MW) |
・開発/薬事戦略の立案と提案
・PMDA相談のための資料作成、申し込み、会議出席、照会事項対応 ・治験薬概要書、プロトコル、同意文書等の作成 ・治験届と照会事項対応 ・治験国内管理人業務 ・オーファン薬の登録申請 ・Common Technical Document(CTD)作成 |
|
戦略的提携/ ライセンス |
・提携候補会社/ライセンシーの調査と分析
・提携候補会社/ライセンシーとの面談、製品/技術の説明 ・パートナリング目的のカンファレンスへの参加 ・Due Diligenceのサポート ・契約交渉のサポート |
契約実績 – (2019年1月~2021年4月)
|
契約年 |
製品/技術 |
スポンサー 国籍 |
疾患領域 |
最も先行する国での 開発段階 |
契約サービス内容 |
||
|
市場分析 |
薬事/開発 戦略等 |
戦略的提携 /ライセンス |
|||||
|
2019年 |
低分子化合物 |
A国 |
皮膚疾患 |
申請準備中 |
● |
||
|
核酸 |
A国 |
炎症、感染症 眼疾患 |
非臨床 |
● |
|||
|
低分子化合物 |
A国 |
神経痛 |
Phase I |
● |
|||
|
モノクローナル抗体 |
A国 |
炎症性疾患 |
申請準備中 |
● |
|||
|
低分子化合物 |
B国 |
消化器疾患 |
Phase II/Ⅲ |
●(ICCC) |
|||
|
低分子化合物 |
C国 |
神経変性疾患 |
Phase I/II |
● |
● |
||
|
2020年 |
低分子化合物 |
D国 |
神経内科 |
Phase I |
● |
● |
|
|
再生医療等製品 |
E国 |
眼疾患 |
申請準備中 |
● |
●(CTD) |
||
|
再生医療等製品 |
A国 |
心臓疾患 |
Phase I/II |
● |
|||
|
モノクローナル抗体 |
A国 |
悪性腫瘍 |
Phase I/II |
● |
|||
|
2021年 |
低分子化合物 |
F国 |
眼疾患 |
非臨床 |
● |
||
●:サービス提供中 ●:サービス提供終了
ICCC: In-Country Clinical Caretaker (治験国内管理人)
CTD: Common Technical Document (医薬品の承認申請のための国際共通化資料)(同社決算説明資料より)
(2)アジアの戦略
21/3期の売上高9.2億円を早期に15億円まで拡大し、営業利益率15%を達成する。また、現在109名の人員を早期に200名まで拡大し、長期では自前の拡大にて400名体制を確立する。具体的な戦略としては、日本、欧州、米国の製薬会社による国際共同治験へのAsia地域の組入れを提案する。また、Asia地域のバイオテックによる日本、欧州、米国での開発需要の取込みを図る。加えて、中国市場の開拓進める。
(3)欧州の戦略
21/3期の売上高19百万EUROを早期に30百万EUROまで拡大し、営業利益率15%を達成する。また、現在191名の人員を早期に300名まで拡大し、長期では自前とM&Aも活用した拡大にて400名体制を確立する。具体的な戦略としては、がん、免疫疾患に加え、CNS領域を強化する。また、Sanofi、Bayer、Rocheとの取引拡大に加え、有望バイオテック企業との取引を開拓し拡大する。更に、CROサービスとFSPモデルサービスの両輪で拡大目指す。
(4)米国の戦略
21/3期の売上高20.1百万USDを早期に30百万USDまで拡大し、営業利益率15%を達成する。また、98名の人員を早期に150名まで拡大し、長期ではM&Aも活用した拡大にて400名体制を確立する。具体的な戦略としては、がん、ワクチンから CNS、免疫等に領域を拡大する。また、次のギリアドとなるようなバイオテック企業との取引開拓に注力し、顧客と二人三脚での成長を目指す。現在2社の有望バイオテックと良好な関係を構築しており、今後10社程度にまでの拡大を図る。加えて、カナダ、メキシコなどラテンアメリカ地域への展開を検討する。
3.2021年3月期決算
(1)連結業績
|
20/3期 |
構成比 |
21/3期 |
構成比 |
前期比 |
|
|
売上高 |
10,935 |
100.0% |
10,279 |
100.0% |
-6.0% |
|
売上総利益 |
3,530 |
32.3% |
2,767 |
26.9% |
-21.6% |
|
販管費 |
2,525 |
23.1% |
2,314 |
22.5% |
-8.4% |
|
営業利益 |
1,005 |
9.2% |
453 |
4.4% |
-54.9% |
|
経常利益 |
918 |
8.4% |
588 |
5.7% |
-35.9% |
|
親会社株主に帰属する当期純利益 |
482 |
4.4% |
539 |
5.3% |
+11.8% |
*単位:百万円
*数値には(株)インベストメントブリッジが参考値として算出した数値が含まれており、実際の数値と誤差が生じている場合があります。(以下同じ)
前期比6.0%の減収、同54.9%の営業減益
売上高は前期比6.0%減の102億79百万円、営業利益は同54.9%減益の4億53百万円。
同社は日亜米欧18ヵ国(イタリア、カナダ、南アフリカ共和国を含む)に展開しており、21/3期の業績は各地域の新型コロナウイルス感染症の状況や対応の相違によって差異が生じた。米国は、治験業務に関してリモートでの治験実施を可能とする制度対応が取られ、米国子会社がこれらに迅速に対応したことで、前期から進めている営業体制強化によって大きく積み上げた受注案件を順調に消化し、組織、業務体制の効率化の効果と相まって2020年8月以降は安定的に営業黒字化した。この結果、通期においても上期の新型コロナウイルス感染症の影響による業績の出遅れを穴埋めし、のれん償却費控除後の営業利益において大幅な黒字を達成した。欧州は、同社の主要拠点国であるドイツ、フランス、スペイン等で複数回のロックダウンが実施され、医療機関への訪問規制などが行われた結果、受注案件の進捗・消化が未達に終わるなど、新型コロナウイルス感染症の影響を大きく受けたものの、第4四半期には業績に回復の兆しが見え、最終的に営業黒字を確保した。日本・アジアは、新型コロナウイルス感染症の影響及び開発案件の絞り込みなど製薬会社の開発計画の修正の影響を受け、21/3期の売上に貢献する受注の確保が進まなかった。その一方で、足元製薬会社において新型コロナウイルス感染症収束後を見越して一時凍結等していた研究開発投資を再始動するなど、新規案件の引き合いが増加しており、今後の売上増加に貢献する新規受注の獲得が増加している。売上総利益率は26.9%と前期比5.4ポイント低下したものの、支払手数料やのれん償却額等の減少により販管費が同8.4%減少し、売上高対販管費率は22.5%と同0.6ポイント低下した。また、前期48百万円の為替差損が今期14百万円の為替差益に転じたことや、補助金収入1億26百万円の計上があったことなどにより、経常利益は前期比35.9%減の5億88百万円と営業利益の減益率を下回った。その他、親会社株主に帰属する当期純利益は米国子会社が買収以前に受託していた案件に関する仲裁やAccelovance, Inc.の売主との交渉に関連する弁護士報酬等の費用に加え、顧客への解決金の支払いが発生した一方、米国子会社で税金の還付2億85百万円や業績改善による将来の課税所得の発生見込み等に基づき繰延税金資産を計上したことに伴い法人税等調整額2億円が発生したことにより前期比11.8%の増益となった。
セグメント別売上高・利益
|
20/3期 |
構成比 |
21/3期 |
構成比 |
前期比 |
|
|
CRO事業 |
9,902 |
90.6% |
9,329 |
90.8% |
-5.8% |
|
育薬事業 |
1,032 |
9.4% |
949 |
9.2% |
-8.0% |
|
連結売上高 |
10,935 |
100.0% |
10,279 |
100.0% |
-6.0% |
|
CRO事業 |
2,247 |
85.9% |
1,765 |
87.7% |
-21.4% |
|
育薬事業 |
368 |
14.1% |
247 |
12.3% |
-32.8% |
|
調整額 |
-1,610 |
– |
-1,559 |
– |
– |
|
連結営業利益 |
1,005 |
– |
453 |
– |
-54.9% |
*単位:百万円
CRO事業は、世界的な新型コロナウイルス感染症拡大の影響を受け、医療機関への訪問規制などにより一部治験業務の実施が困難となったことや新規獲得案件の治験開始時期に遅延があったこと等により受注残高の回収による売上計上が遅れたこと等から、減収減益となった。売上高は前期比5.8%減少した。また、売上高の減少により、セグメント利益は同21.4%減少した。セグメント利益率は、18.9%と前期比3.8ポイント低下した。
育薬事業にいても、CRO事業と同様に新型コロナウイルス感染症拡大の影響を受け、減収減益となった。売上高は前期比8.0%減少した。また、売上高の減少により、セグメント利益は同32.8%減少した。セグメント利益率は、26.1%と同9.6ポイントの低下となった。
各国単体の業績動向
【日本】
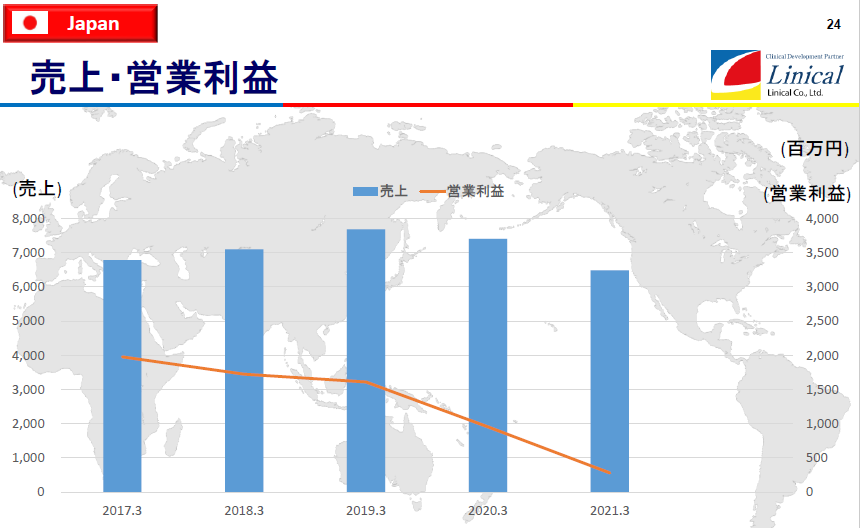
(同社決算説明会資料より)
20/3期及び21/3期 は、新型コロナウイルス感染拡大による医療機関への訪問規制により受注案件の消化が進まなかったことや、開発案件の絞り込みなど製薬会社の開発計画の修正の影響を受け、売上に貢献する受注の確保が進まず前期比で減収減益となった。
【アジア】
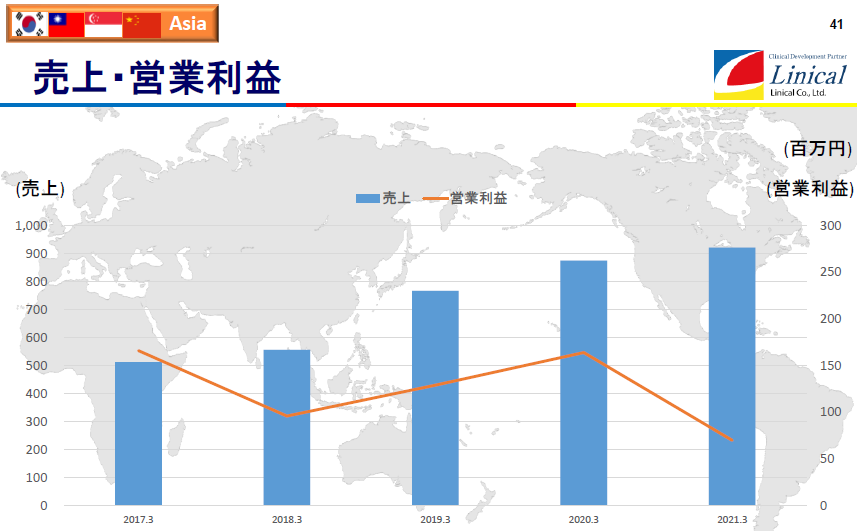
(同社決算説明会資料より)
上グラフでは、19/3期から2018年4月に買収した米国Accelovance社(現Linical Accelovance America(LAA) 社)の中国事業が含まれている。21/3期は、医療機関への訪問規制などが行われた結果、受注案件の進捗・消化が未達に終わるなど、新型コロナウイルス感染症の影響を大きく受け前期比で減益となった。なお、17/3期から19/3期の営業利益は、韓国事業が負担するのれんの償却費を控除する前の金額となっており、韓国子会社買収により発生したのれんは19/3期に償却が完了した。
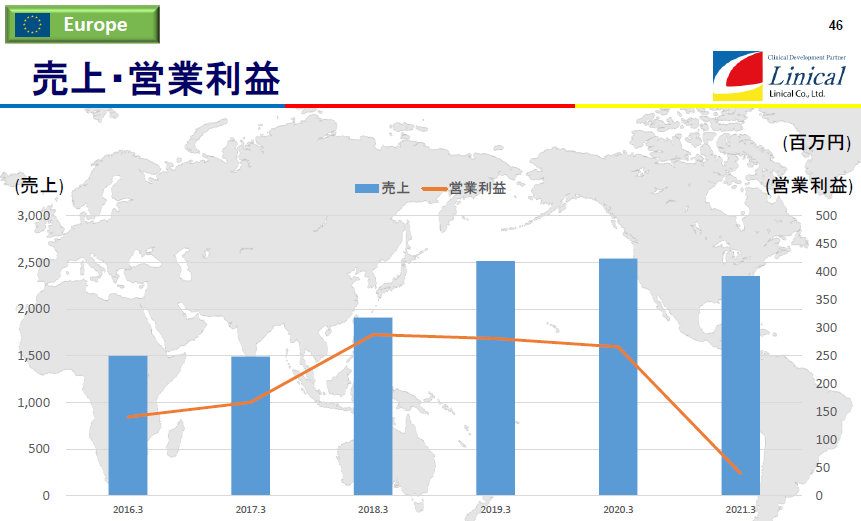
【欧州】
(同社決算説明会資料より)
上グラフ では、19/3期から2018年4月に買収した米国Accelovance社(現Linical Accelovance America(LAA) 社)の欧州事業が含まれている。21/3期は、主要拠点国であるドイツ、フランス、スペイン等で複数回のロックダウンが実施され、医療機関への訪問規制などが行われた結果、受注案件の進捗・消化が未達に終わるなど、新型コロナウイルス感染症の影響を大きく受け、第4四半期に業績回復の兆しが見え、最終的に営業黒字を確保したものの前期比で減収減益となった。なお、上グラフの営業利益は、欧州事業が負担するのれん及びPPAに伴う無形固定資産の償却費を控除する前の金額となっている。
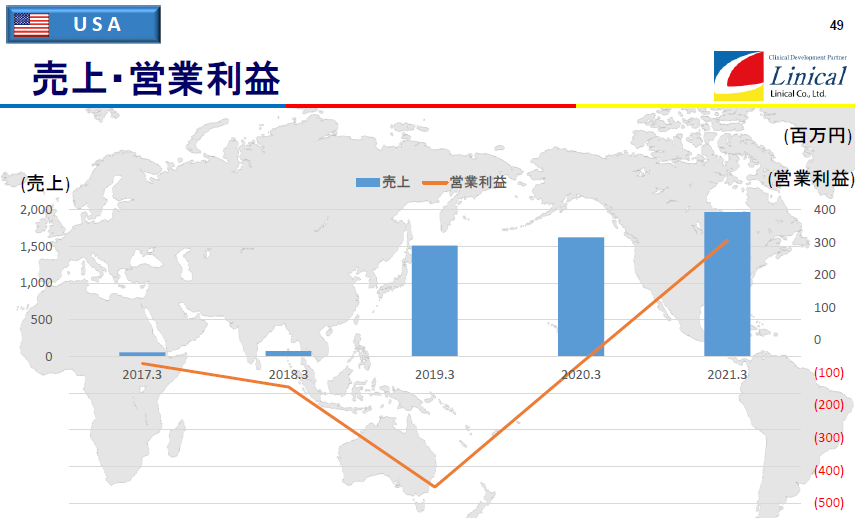
【米国】
(同社決算説明会資料より)
2018年4月に米国Accelovance社(現Linical Accelovance America(LAA) 社)を買収し、19/3期から取り込まれた数値。19/3期は、LAA社の買収費用に加え、LAA社で複数の既存案件の試験中止なども発生し、大幅な営業赤字となった。一方、21/3期は、新型コロナウイルス感染症拡大の影響はあるものの、リモートでの治験実施を可能とする制度対応などもあり、前期から進めている営業体制強化によって大きく積み上げた受注案件を順調に消化し、組織、業務体制の効率化の効果と相まって 2020年8月以降は安定的に営業黒字化し、通期においても上期の出遅れを穴埋めし、のれん償却費控除後の営業利益において大幅な黒字を達成した。なお、上グラフの営業利益は、米国事業が負担するのれん及び PPA に伴う無形固定資産の償却費を控除する前の金額となっている。
のれんの残高と残存償却期間(2021/3期末)
|
金額 |
残存償却期間 |
年間償却額※4 |
|
| 韓国 |
19/3期で償却終了 |
||
| 欧州 ※1、2 |
1,378 |
12-13年 |
107 |
| 米国 ※1、3 |
2,084 |
13年 |
152 |
※1 Linical Accelovance America, Inc. Inc.(以下、 LAA )買収により発生したのれんについて、その欧州子会社分をEUROPEに按分。
※2 のれん以外にPurchase Price Allocationにより認識された無形固定資産の21/3期末残高は91百万円。これらの残存償却期間は6~10年。
※3 のれん以外にPurchase Price Allocationにより認識された無形固定資産の21/3期末残高は50百万円。これらの残存償却期間は6年。
※4 105円/ドル、125円/ユーロで換算した数値。
(2)受注残高の推移
|
20/3期 期末 (A) |
21/3期 期末 |
21年5月14日現在 (B) |
前期末比 (B-A)/A |
|
|
中外製薬 |
3,227 |
3,351 |
3,266 |
+1.2% |
|
エーザイ |
3,802 |
2,926 |
3,026 |
-20.4% |
|
小野薬品工業 |
1,328 |
841 |
789 |
-40.5% |
|
その他 |
11,541 |
12,077 |
11,681 |
+1.2% |
|
受注残高合計 |
19,900 |
19,196 |
18,764 |
-5.7% |
*単位:百万円
同社が受託する業務は、1年から3年程度の治験実施期間において、症例数や対象疾患に起因する治験の難易度などにより受託総額が決定する。この実施期間についてクライアントと委受託契約を締結し、契約に従い毎月売上が発生する。このため、今後1年から5年程度の期間で発生する売上高を示しており、同社グループの今後の業績予想の根拠となる指標である。
2021年5月14日時点の受注残高は、前期末(2020年3月)に比べ、5.7%減少した。これは、欧州の既存案件で新型コロナウイルス感染症の拡大の影響により治験期間の終了時期の前倒しが決定し契約変更の完了により受注残高が減少したことや、米国で顧客による開発案件の優先順位の見直しがあり、契約のキャンセルがあったこと等によるものである。なお、キャンセルのあった米国の顧客との間ではこれに代替する開発案件の提案依頼を受けており、契約に向けて協議中である。こうした一方で、製薬会社はワクチン接種の開始による新型コロナウイルス感染症収束後を見越し、一時凍結等していた研究開発投資を再始動するなど、足元の新規案件の引き合いは大きく増加しており、欧州発の日亜欧試験を獲得するなど今後の売上に貢献する新規受注の獲得が増加している。更に、直近では日亜米欧の大型案件の受注内定を受け契約締結作業を進めており、実質的な受注残高は200億円を超える水準となっている模様である。
(3)財政状態及びキャッシュ・フロー(CF)
財政状態
|
20年3月 |
21年3月 |
20年3月 |
21年3月 |
||
|
現預金 |
5,210 |
5,084 |
短期有利子負債 |
1,469 |
1,150 |
|
売上債権 |
2,057 |
2,982 |
未払金・未払費用 |
1,060 |
1,120 |
|
立替金 |
821 |
1,183 |
前受金 |
1,534 |
1,909 |
|
流動資産 |
8,517 |
9,722 |
長期有利子負債 |
3,179 |
3,541 |
|
有形固定資産 |
741 |
701 |
負債 |
8,922 |
9,568 |
|
無形固定資産 |
4,033 |
3,651 |
純資産 |
5,338 |
5,712 |
|
投資その他 |
968 |
1,204 |
負債・純資産合計 |
14,260 |
15,280 |
|
固定資産 |
5,743 |
5,557 |
有利子負債合計 |
4,649 |
4,692 |
*単位:百万円
*有利子負債=借入金+リース債務
2021年3月末の総資産は前期末比10億19百万円増の152億80百万円。資産サイドは売上債権、立替金等が、負債純資産サイドは、主に前受金、親会社株主に帰属する当期純利益の計上による利益剰余金等が主な増加要因。2021年3月末ののれんは、34億63百万円と同3億69百万円減少。また、2021年3月末の自己資本比率は37.4%と前期末から変化がなかった。
キャッシュ・フロー
|
|
20/3期 |
21/3期 |
前期比 |
|
|
営業キャッシュ・フロー(A) |
1,192 |
23 |
-1,168 |
-98.0% |
|
投資キャッシュ・フロー(B) |
-144 |
169 |
313 |
– |
|
フリー・キャッシュ・フロー(A+B) |
1,048 |
192 |
-855 |
-81.6% |
|
財務キャッシュ・フロー |
-903 |
-329 |
573 |
– |
|
現金及び現金同等物期末残高 |
5,210 |
5,084 |
-126 |
-2.4% |
*単位:百万円
CF面では、税金等調整前当期純利益の減少や前受金の増加額の減少などにより、営業CFのプラス幅が縮小した。また、子会社株式の取得対価の調整に伴う一部対価の返還による収入の計上により投資CFがプラスに転じたものの、フリーCFのプラス幅も縮小した。その他、長期借入れによる収入などにより財務CFのマイナス幅が縮小した。これらにより、期末のキャッシュポジションは、前期末比で2.4%減少した。
(4)最近のトピックス
【新型コロナウイルス感染症治療薬治験受託】
同社は、2020年9月9日に学校法人北里研究所との間で、イベルメクチン(注)の新型コロナウイルス感染症に対する適応追加を目指した医師主導治験についての治験業務委託契約を締結した。同社は、治験業務においてRisk Based Monitoringの手法を導入し、信頼性の高いデータの収集を行い、迅速、確実な開発の実現に貢献することで患者の健康的な生活に寄与していく方針である。
(注)イベルメクチンは、2015 年にノーベル生理学・医学賞を受賞した大村智北里大学特別栄誉教授が発見したマクロライド
系抗生物質。動物薬として寄生虫駆除に用いられるほか、オンコセルカ症(河川盲目症)やリンパ系フィラリア症など寄生虫感染症薬としてアフリカ・中南米を中心に 2019 年は約 4 億人が服用している。
【海外子会社における法人税等の還付】
米国において新型コロナウイルス経済救済法「Coronavirus Aid, Relief, and Economic Security Act(CARES Act)」が2020年3月27日に制定されたことに伴い、LAA社は2018年1月1日以降に開始する連結会計年度に生じた繰越欠損金について繰り戻し還付申請が承認されたことから、2億85百万円の法人税等に係る還付を受領した。
【Accelovance, Inc. の買収価格確定に伴う売主からの支払】
同社の連結子会社であるLinical USA, Inc. (以下「LUI社」)が、2018年4月に買収したAccelovance, Inc. (現Linical Accelovance America, Inc.(以下「LAA社」))の売主との間で買収価格に最終合意し、2,509千ドルの支払いを受けた。LUI社は、2018年4月に買収した現LAA社の売主との間で買収価格の調整に関する交渉を続けていたが、買収価格30,447千ドルに最終合意し、価格調整前の買収価格との差額2,509千ドルについてエスクローから支払いを受けた。この結果、LUI社が保有するLAA社への投資簿価が2,509千ドル減少する。また、LAA社買収により発生したのれんの金額も同額減少することになるため、21/3期においてのれんの金額と過去ののれん償却費の超過額について調整を行った。
4.2022年3月期業績予想
(1)連結業績
|
21/3期 実績 |
構成比 |
22/3期 予想 |
構成比 |
前期比 |
|
|
売上高 |
10,279 |
100.0% |
10,700 |
100.0% |
+4.1% |
|
営業利益 |
453 |
4.4% |
683 |
6.4% |
+50.6% |
|
経常利益 |
588 |
5.7% |
- |
– |
– |
|
親会社に帰属する 当期純利益 |
539 |
5.3% |
- |
– |
– |
*単位:百万円
経常利益と親会社株主に帰属する当期純利益の連結業績予想は、為替相場の変動など未確定な要素が多く非公表。
前期比4.1の増収、同50.6%の営業増益
22/3期の会社予想は、売上高が前期比4.1%増の107億円、営業利益が同50.6%増の6億83百万円の予想。
米国は、治験業務に関してリモートでの治験実施を可能とする制度対応が取られるなど受注した業務を実施し売上を計上できる環境にある。製薬会社においても新型コロナウイルス感染症収束後を見越し、一時凍結等していた研究開発投資を再始動するなど、足元の新規案件の引き合いは大きく増加しており、今後の新規受注の増加が見込まれる。こうした状況を反映し、米国においては22/3期第2四半期より新型コロナウイルス感染症の影響を勘案することなく順調に業績が推移すると予想している。欧州においても、製薬会社が新型コロナウイルス感染症収束後を見越して一時凍結等していた研究開発投資を再始動するなど、足元で新規案件の引き合いが増加しており、欧州発の日亜欧試験を獲得するなど新規受注の獲得が増加している。しかし、上半期においては、新型コロナ感染症の影響による一部治験実施の制約が残る可能性が高く、ワクチン接種が進捗し経済活動の回復が見込まれる第3四半期以降の業績の正常化を見込んでいる。また、日本・アジアは、上半期中はこれまでの新型コロナ感染症拡大による低調な受注環境の影響が残る。足元では製薬会社が新型コロナウイルス感染症収束後を見越して一時凍結等していた研究開発投資を再始動しており、直近で日亜米欧のグローバル試験で受注内定を受けた他、新規案件の引き合いが増加しているものの、第4四半期からの業績回復を予想している。
売上高営業利益率は、前期比2ポイント上昇の6.4%の見込み。経常利益と親会社株主に帰属する当期純利益の連結業績予想は、為替相場の変動など未確定な要素が多いことから非公表とされた。
配当は前期と同額の1株当たり普通配当14円の予想。
(2)各国の今後の経営展開
【コロナ禍における経営展開】
(利益確保の戦略)
| 日本 | ①新卒者の採用を抑制し、雇用の安定を図る |
| アジア | ①新規採用の抑制による利益確保
②現地バイオテックの開発需要の開拓 |
| 米国 | ①米国CRO 市場の強さを反映し、 PM 新規採用を含む組織増強 |
| 欧州 | ①新規採用の抑制による利益確保
②Linical EuropeとLinical Accelovance Europeの統合によるシナジーを追求 |
(投資戦略)
| アジア | ①Linical ChinaとLinical Accelovance Chinaとの統合を検討 |
| 米国 | ①次の成長戦略の中心と位置づけ投資継続
②米国 CRO 市場の強さを反映し、 PM 採用を含む組織増強を継続 ③がん、ワクチンに加え、CNS、免疫領域を強化 ④Linical CANADAの設立検討、メキシコなどラテンアメリカへの進出を検討 |
| 欧州 | ①がん、免疫に加え、CNS領域を強化 |
【アフター・コロナ禍の経営展開】
(利益確保の戦略)
| 日本 | ①Oncology、CNS、Immunologyに加え、再生医療、皮膚科、眼科領域に進出本格化
②臨床研究法施行による企業主導臨床研究関連業務ニーズの取り込み ③創薬支援事業の拡大とCRO 事業とのシナジーを高める ④グローバル体制確立によるグローバル試験の営業強化 |
| アジア | ①韓国、台湾に続き、中国ビジネスの拡充を進めアジア地域の利益貢献化を進める |
| 欧州 | ①競争力強化により利益率向上を目指す
②Linical EuropeとLinical Accelovance Europeの統合によるシナジーを加速 |
(投資戦略)
| 日本 | ①Linical Australiaの設立検討 |
| アジア | ①Linical ChinaとLinical Accelovance Chinaを統合し、規模拡大を検討
②シンガポール事業を安定化 ③フィリピン、インドネシアなど人口の多いアジア地域への進出を検討 |
| 米国 | ①次の成長戦略の中心と位置づけ投資継続、400名体制を目指し、次のM&Aも検討
②米国CRO市場の強さを反映し、PM採用を含む組織増強を継続 ③CNS領域を強化 ④Linical CANADAの設立検討、メキシコなどラテンアメリカへの進出を検討 |
| 欧州 | ①CNS領域を強化
②最終的に400名体制構築のため自前or M&A活用を検討 ③Linical Italy、Linical South Africaの設立検討 |
(3)抗アルツハイマー型認知症(AD)薬臨床試験受託の拡大
アルツハイマー型認知症(AD)患者はすべての認知症患者の6~7割を占め、全世界で約4,900万人、日本で560万人と推定され、治療満足度及び薬剤貢献度がともに最も低い。また、いまだに治療法が見つかっていない疾患であり、新薬開発に対する医療ニーズも大きい。ADを標的とする開発化合物は126品目、臨床試験は152試験が実施されており(2021年1月5日時点)、うち8割はアルツハイマー型認知症の病態の本質的な過程に作用して疾患の進行を抑制する”疾患修飾療法”(DMT:Disease-modifying therapeutics)である。2021年6月7日(現地時間)に、DMTとして世界で初めてアデュカヌマブ(バイオジェン・エーザイ)がFDAに承認され、米国でADの新薬が承認になるのは18年ぶりとなる。アデュカヌマブの対象は軽度認知障害(MCI)患者から早期AD患者であるが、極めて早期のAD(プレクリニカルAD)患者にDMTを予防的に適用し、発症時期を遅らせる治療アプローチが既にスタートしている。
同社はこれまで、抗アルツハイマー型認知症(AD)薬の臨床試験を複数受託している。こうした、受託実績を武器に今後抗AD薬の臨床試験の大型受託の獲得を目指す方針である。
【同社の抗AD薬臨床試験受託実績(2012年~現在)】
|
フェーズ |
開発化合物数 |
試験数 |
備考 |
| Ⅳ(育薬) | 該当せず | 4 | ADの新規スケール作成から検証及び実証 |
| Ⅲ | 2 | 6 | いずれも継続試験進行中 |
| Ⅱ | 3 | 3 | いずれも完了 |
| Ⅰ | 1 | 2 | いずれも完了 |
| 合計 | 6 | 15 |
(同社決算説明会資料より)
5.今後の注目点
新型コロナウイルス感染症拡大の影響を受け、足元伸び悩んでいる受注残高ではあるものの、契約締結作業中の日亜米欧の大型治験案件を加えると、実質的な受注残高は、200億円を超える水準となっている模様である。ワクチン接種の進捗に伴う新型コロナウイルス感染症収束後を見越して製薬会社が一時凍結等していた研究開発投資を徐々に再開しているものと推測される。同社が得意とするがん領域や中枢神経領域などにおける新薬の研究と開発はいつまでも抑制できるものではなく、今後グローバル規模での臨床試験が本格化するものと予想される。同社グループのみによる大規模な国際共同試験の受託は、1件当たりの受注単価の大幅な増加につながり、同社の成長を加速させる。今後大規模な国際共同試験の受注を獲得できるのか注目される。また、米国子会社においては、新型コロナウイルス感染症の影響による上期の出遅れをカバーし、のれん償却費控除後の営業利益で大幅な黒字を達成した。近年推し進めた営業体制の強化に加え、組織・業務体制の効率化の成果と言えよう。収益環境が安定してきたことから今後積極的な拡大戦略の実施が可能となった。米国には有望なバイオテック企業が多数存在する。今後成長著しいバイオテック企業との取引深耕が図られるのか注目される。
加えて、18年ぶりに米国でアルツハイマー型認知症(AD)の新薬がFDAで承認されたことは無視できない。疾患修飾療法としては世界初となるが、いまだに治療法が見つかっていない疾患であるADにおける新薬の開発競争が今後激化するものと予想される。同社はこれまでにAD薬の臨床試験を複数受託しており、この分野においても既に実績を積み上げている。今後拡大が予想されるAD分野において大規模な臨床試験を受託できるのか期待を込めて注目したい。
<参考:コーポレート・ガバナンスについて>
◎組織形態および取締役・監査役の構成
| 組織形態 | 監査役設置会社 |
| 取締役 | 9名、うち社外2名 |
| 監査役 | 3名、全員社外監査役 |
◎コーポレート・ガバナンス報告書
最終更新日:2021年07月01日
コーポレート・ガバナンス・コード適用以降のコーポレート・ガバナンス報告書直近の提出日、2020年07月01日。
<基本的な考え方>
当社は、その有している医薬品開発の技術をもって国内大手製薬会社のパートナーとして医薬品開発に貢献し、医薬品の分野から社会全体の期待に応えてまいります。さらに、企業価値を高めていくためには、健全性と透明性が確保された迅速な意思決定を可能にする体制の整備が必要であると考えております。 この考えに基づき、最重要課題であるコンプライアンスの徹底を含む内部統制の強化を図っております。
<コーポレート・ガバナンス・コード各原則の実施について>
実施をしないコードのおもな原則と理由
|
原則 |
実施しない理由 |
| 【補充原則1-2④ 株主総会における権利行使】 | 当社は、株主が議決権行使を行いやすい環境の整備は必要であると認識しております。議決権の電子行使を可能とするための環境作り(議決権電子行使プラットフォームの利用等)や招集通知の英訳については、機関投資家並びに海外投資家の比率等を勘案しながら、導入を検討してまいります。 |
| 【原則1-3 資本政策の基本的な方針】 | 当社は、株主価値を中長期的に高め、持続的成長を実現するため、財務健全性の確保と持続的成長に向けた戦略的投資を行います。具体的には、財務健全性の確保については、成長投資とリスクを許容できる株主資本の水準を保持することを基本とします。持続的成長に向けた戦略的投資については、内部留保資金を、将来の事業発展に必要不可欠な国際共同治験への体制構築のための投資やM&Aによる拠点拡充などに活用し、資本効率の向上に努めます。株主への利益還元である配当については、中長期的な成長による企業価値向上と利益還元のバランスの最適化を図ることを基本方針とし、安定的な利益還元に努めます。以上の資本政策の基本的な方針に関し、今後、Webサイト上等でご説明できるよう検討してまいります。 |
| 【<補充原則4-1② 取締役会の役割・責務(1)】 | 当社では、経営会議において中期計画を検討し、各会議において進捗状況の確認、分析を行い、必要に応じて適宜、中期目標や方針の見直しを行うこととしております。取締役会は、経営会議が策定した中期計画を決議するとともに、進捗状況や分析結果について報告を受け、監視、監督することとしております。現在当社では中期計画を公表しておりませんが、決算説明会(年2回)ならびに個人投資家説明会(年2回)において、長期的な経営戦略、ビジョンを説明するとともに説明会資料等を開示し、株主・投資家との共有認識を醸成できるよう努めております。今後、中期計画の公表について検討してまいります。 |
| 【原則4-9 独立社外取締役の独立性判断基準及び資質】 | 当社は、一般株主と利益相反が生ずるおそれがない客観的な独立性判断基準等の開示に関して慎重に検討をしてまいります。 |
<開示している主な原則>
|
原則 |
開示内容 |
| 【原則1-4 政策保有株式】 | 当社は、株価変動というリスクの回避のため、また資本効率の向上のためという2つの理由から、協業・提携のための株式保有等の必要がある場合を除き、上場株式を保有しません。 |
| 【補充原則4-11① 取締役会・監査役会の実効性確保のための前提条件】 | 当社は、医薬品開発を主たる事業としております。このため取締役会は、迅速かつ的確な意思決定ならびに執行の監督が行えるよう、新薬開発をはじめとした医薬品業界の業務に精通し、深い知識・経験を有する者を中心に構成しています。さらに、財務・会計の専門知識を有する者、海外で当該事業のグローバル展開を経験した者等がガバナンスの充実や成長戦略に関して積極的に意見を述べ、活発な議論が行える体制を整えています。現在、取締役会は社外取締役2名を含む9名で構成されており、このうち女性を1名含んでおります。 |
| 【補充原則4-11② 取締役会・監査役会の実効性確保のための前提条件】 | 現在、当社の取締役・監査役は、その役割・責務を適切に果たすため、独立社外取締役を除き、他の上場会社役員の兼務は行っておりません。また、利益相反取引の観点からも、他社の役員の兼務については取締役会にて決議を行い、兼務する場合であっても合理的な範囲にとどめることを前提といたします。なお、取締役・監査役の他社との主な兼務状況は、従来から毎年事業報告において適切に開示を行っております。 |
| 【補充原則4-11③ 取締役会・監査役会の実効性確保のための前提条件】 | 当社取締役会は、(取締役1名が期中辞任のため)取締役10名、監査役3名へのアンケート及びその結果に基づく討議にて、取締役会の実効性を以下の通り評価いたしました。
1.取締役会の構成 人数規模、社内外取締役の割合、知識・経験・専門性・性別などの多様性の観点で肯定的な回答が多く、適切であると評価できるが、中長期的な成長に向けた課題として、グローバル化やDX対応等への専門性強化や経験蓄積が望まれる。 2.取締役会の運営 開催頻度、議題の整備、資料の効率化や早期配布など肯定的回答が多く、適切であると評価できる。 3.議論の活性化、内容審議時間と内容、発言量、迅速かつ柔軟な意思決定、業務監督(モニタリング)等については肯定的な回答が多く、適切であると評価できる。一方で、戦略的な重要議案により多くの時間を割き議論の質を向上させるために、社外取締役への事前説明のより一層の充実を求める回答もみられた。なお、当社では、重要な審議事項については、取締役会に先立ち、社内取締役と執行役員が日頃より密接なコミュニケーションをとり経営会議などで事前審議を行うとともに、社外取締役に対しては、毎月の定例取締役会に先立ち事前に資料を提供しCFOおよび経営企画室から説明と質疑応答を実施することで、取締役会での意思決定における適切性・妥当性を確保しております。以上より、取締役会の実効性は確保されている旨の結論を得ました。今後も、引き続き戦略課題の審議を充実させ、実効性を高めるためのモニタリングや議論を続けてまいります。 |
| 【原則5-1 株主との建設的な対話に関する方針】 | 当社では、企業と株主(潜在株主としての機関投資家や個人投資家を含む)の共通目的である企業価値の持続的成長を目指し、信頼関係を構築するために、業績、経営戦略、資本政策、リスク、コーポレート・ガバナンス体制などについて以下の方法により継続的・建設的で透明・公正な対話を実施しております。-株主との対話は専務取締役CFOが統括を行い、面談の目的と効果、株主属性を勘案し、代表取締役社長、専務取締役CFOを中心とした経営幹部により対話者と対話方法を検討のうえ実施しています。-IRは財務部ならびに経営企画室が中心となり社内関連部署から必要情報を収集し、分かり易い資料作成や説明により株主との対話を充実させています。-定時株主総会、決算説明会(年2回)、個人投資家向け説明会(年2回)、四半期決算開示毎の国内外機関投資家・アナリストとの会議、ホームページでのIR情報開示、個人投資家様からの電話・メール等による問い合わせへの個別対応などを通じて対話の機会を持ち、質問や要望、説明会での参加者情報やアンケート結果などをIR活動へ反映しています。-株主との対話を通じて把握した株主の関心や懸念は専務取締役CFOに集約し、経営分析や情報開示の在り方などの検討に活かしています。-IR活動や株主との対話においては、社内規程の定めるところに従い、適切にインサイダー情報を管理しております。なお、当社では決算情報に関する対話を控える沈黙期間を四半期決算期日の翌日から決算短信発表日までを沈黙期間としております。 |

