(4597)ソレイジア・ファーマ株式会社 販路整備と新薬開発に焦点
|
 荒井 好裕 社長 |
ソレイジア・ファーマ株式会社(4597) |
|
 |
企業情報
|
市場 |
東証マザーズ |
|
業種 |
医薬品(製造業) |
|
代表取締役社長 |
荒井 好裕 |
|
所在地 |
東京都港区芝公園2-11-1 住友不動産芝公園タワー4F |
|
決算月 |
12月末日 |
|
HP |
株式情報
|
株価 |
発行済株式数 |
時価総額 |
ROE(実) |
売買単位 |
|
|
200円 |
105,450,795株 |
21,090百万円 |
– |
100株 |
|
|
DPS(予) |
配当利回り(予) |
EPS(予) |
PER(予) |
BPS(実) |
PBR(倍) |
|
0.00円 |
– |
-28.54円 |
– |
51.58円 |
3.9倍 |
*株価は12/11終値。発行済株式数、DPS、EPS、BPSは19年12月期第3四半期決算短信より。EPSは予想レンジの下限。ROEは前期実績。
業績推移
|
決算期 |
売上高 |
営業利益 |
経常利益 |
当期利益 |
EPS |
DPS |
|
2014年12月(実) |
11 |
-702 |
-701 |
-677 |
-26.90 |
0.00 |
|
2015年12月(実) |
229 |
-702 |
-710 |
-643 |
-24.83 |
0.00 |
|
2016年12月(実) |
501 |
-462 |
-494 |
-474 |
-18.46 |
0.00 |
|
2017年12月(実) |
410 |
-1,009 |
-1,016 |
-1,007 |
-12.24 |
0.00 |
|
2018年12月(実) |
318 |
-2,420 |
-2,445 |
-2,422 |
-25.98 |
0.00 |
|
2019年12月(予) |
500 ~1,700 |
-3,000 ~-2,000 |
-3,000 ~-2,000 |
-3,000 ~-2,000 |
-28.54 ~-19.02 |
0.00 |
*予想は会社側予想。IFRS適用。当期利益は親会社の所有者に帰属する当期利益。以下同様。
ソレイジア・ファーマの2019年12月期第3四半期決算概要などをご紹介します。
目次
今回のポイント
1.会社概要
2.2019年12月期第3四半期決算概要
3.2019年12月期業績予想と今後の目標
4.今後の注目点
<参考1:製品開発型バイオベンチャーの時価総額推移>
<参考2:コーポレートガバナンスについて>
今回のポイント
- 19年12月期第3四半期の売上収益は前年同期比1億81百万円増の2億91百万円。内訳は「Sancuso® (SP-01)」および「エピシル® (SP-03)」の製品販売、「エピシル® (SP-03)」の中国での承認取得等を契機とするマイルストンやロイヤリティ収入等。研究開発費は、同1億77百万円減少の7億16百万円。主に「ダリナパルシン(SP-02)」の国際共同第II相臨床試験(最終試験)や2018年12月に開始した「PledOx® (SP-04)」の国際共同第III相臨床試験(最終試験)等への臨床開発投資。販管費は、同4億30百万円増加の11億13百万円。中国販売開始に伴うセールス&マーケティングを含む体制構築費用のほか、「Sancuso® (SP-01)」および「エピシル® (SP-03)」の事業進捗により開始された無形資産償却費など。営業損失は同47百万円拡大し、15億85百万円となった。
- 直近の主な進捗は、「ダリナパルシン(SP-02)の第II相臨床試験(最終試験)において被験者の目標症例数到達(2019年9月)」、「PledOx® (SP-04)対象拡大の方針及び権利導入契約を更新(2019年10月)」、「エピシル® (SP-03)の韓国における医療機器輸入販売承認を取得(2019年10月)」など。
- 加えて、2019年12月、「PledOx® (SP-04)」の日本国内における独占的販売権をマルホ株式会社(大阪府大阪市)に導出するライセンス契約を締結。また、今後の両社の緊密な関係維持を図る観点から、マルホがソレイジア・ファーマ株式を引受ける資本提携(第三者割当増資)も実施することとなった。調達資金は新規パイプライン「SP-05」の導入および開発に充当する予定である。
- 業績予想に変更は無い。「Sancuso® (SP-01)」、「エピシル® (SP-03)」販売で売上収益は拡大する一方、先行投資を拡大させるため当期の損失は拡大傾向にある。売上においては各製品が販売開始間もないことから市場浸透速度には不確実性があり、コストにおいては臨床試験などの開始及び終了時期には不確実性があることから、現時点で特定することは困難であるため業績予想はレンジ形式によって発表している。
- 4つのパイプラインのうち「Sancuso® (SP-01)」、「エピシル® (SP-03)」の販売が開始され、「エピシル® (SP-03)」に関しては予定通り韓国においても医療機器輸入販売承認を取得することができた。これに加え、マルホとの「PledOx® (SP-04)」のライセンス契約締結と資本提携は、既存4製品の事業化進展・事業収益計上に加え、新規パイプライン開発開始と、短期及び中長期両面で大きなインパクトをもたらすものである。
- 「開発」のみではなく「販売」も始まり真の製品開発型バイオベンチャーへと進化途上のソレイジア・ファーマの今後を引き続き注目したい。
1.会社概要
がん領域に特化したスペシャリティ・ファーマ(※)として、有望市場である日本、中国を中心としたアジア地域においてがん治療薬、がんサポーティブケア(がん支持療法医薬品等)などの開発及び販売を行う。
荒井社長率いる実務経験豊富な開発スタッフ、開発成功確率の高さ、安定した事業基盤、事業の早期実現可能性などが大きな強み・特長。
(※)スペシャリティ・ファーマ:得意分野において国際的にも一定の評価を得る研究開発力を有する新薬開発企業のこと。
【1-1 沿革】
2006年12月に伊藤忠商事とバイオビジネスに特化した米国のVCであるMPMキャピタルが共同で医薬品開発事業の準備拠点として米国に設立したJapanBridge Inc.が前身。
2008年5月に第1号開発品「Sancuso®(SP-01)」の日本、台湾、シンガポール、マレーシア、中国(香港、マカオ含む)での独占的開発販売権を導入。
2008年9月、ソレイジア・ファーマ株式会社に商号を変更した。
その後、「ダリナパルシン(SP-02)」のアジア太平洋地域の独占的開発販売権導入(2011年3月)、その後米国、欧州諸国を含めた全世界での独占的開発販売権導入(2014年7月)、「エピシル® (SP-03)」の日本、中国での独占的開発販売権導入(2015年3月)などパイプラインの拡充を進めるとともに、「Sancuso®(SP-01)」の台湾、香港、シンガポール、マレーシアでの独占的開発販売権を協和発酵キリン株式会社に導出(2010年2月)、「ダリナパルシン(SP-02)」の日本での独占的開発販売権をMeiji Seika ファルマ株式会社に導出(2015年1月)、「Sancuso®(SP-01)」の中国(北京、上海、広州、香港、マカオを除く)での独占的販売権をLee's Pharmaceutical (HK) Limitedに導出など、収益化への道筋も構築していく。
2016年には「エピシル® (SP-03)」について、中国・日本両国において医療機器製造販売承認を申請するとともに、日本での独占的販売権をMeiji Seika ファルマ株式会社に、中国(北京、上海、広州を除く)での独占的販売権をLee’s Pharmaceutical (HK) Limitedに導出。
がん領域に特化したスペシャリティ・ファーマとしての成長性を期待され、2017年3月に東京証券取引所マザーズに上場した。
2017年11月には「PledOx®(SP-04)」の日本、中国、韓国、台湾、香港及びマカオでの独占的開発販売権を導入し、パイプラインは現在4品目。
2018年5月には「エピシル®(SP-03)」の国内販売が始まり、同社製品初の上市となる。次いで2019年に入り、中国において「Sancuso®(SP-01)」、「エピシル®(SP-03)」が販売開始となるなど、「開発」ステージから「販売・事業化」ステージへと移行中である。
【1-2 企業理念・経営理念】
社名のソレイジア(SOLASIA)は、Sol(ラテン語で太陽)+Asia(アジア地域)からなるもので、「日本・アジアにおいて、
がんと向き合うさまざまな人たちの未来を照らす希望の太陽でありたい。」という想いを表している。
以下のような、『経営理念:ミッション、ビジョン、バリュー』を掲げている。
|
果たすべき役割 (Mission) |
*患者さんの明るい未来のためによりよい医薬品を提供する。 |
|
在るべき姿 (Vision)
|
*国内外で認知され、全てのステークホルダーから高い信頼を得る。 |
|
*全員が、情熱と志、倫理観を持ち、現状を是とせず、高い専門性を保ち、常に未来志向で新しい価値・創造に努め、革新的医薬品を開発するスペシャリティ・ファーマとして認められる存在となる。 |
|
|
*当社の製品を必要とする人々(医療従事者及び患者さん)の要望に応え貢献する。 |
|
|
共有される価値観 (Value)
|
*患者さんのための価値を創造する。 |
|
*高い倫理観を持つ。 |
|
|
*互いに信頼し尊敬する。 |
|
|
*チームで活動する。 |
また、経営方針として以下の2点を示している。
| 当面、大手製薬企業が業績重視の観点から着手しないがん領域、希少疾病領域での新規製品の導入開発を進め、未だ治療薬がないような患者さんへの貢献を果たす。 |
| 4製品の事業化を通じて、経営理念の実現を図るための財務基盤を早期に完成させ、企業として自立する。 |
ニッチではあるが困っている患者が多数いるアンメット・メディカル・ニーズ(いまだに治療法が見つかっていない疾患に対する医療ニーズ)解決のための新薬開発に注力していく。また、現在は研究開発が先行しているため財務CFに頼らざるを得ない現状であるが、早期に営業CF黒字化を実現し、持続的成長が可能な基盤を構築する。
【1-3 同社を取り巻く環境】
厚生労働省「平成30年(2018)人口動態統計月報年計の概況」によれば、2016年の主な死因別死亡率(人口10万人に対し何人が死亡したか)は悪性新生物(がん)が、300.7人で第1位であった。1981年に死亡率142.0人で、同134.3人の脳血管疾患に代わり第1位となって以来30年以上にわたり連続して第1位であり、その数値も年を追って上昇している。
日本では高齢化、また食生活を含めたライフスタイルの変化等によりがん発症率は上昇していると言われているが、中国においてもがんの発症者数及び死亡者数は増加傾向にある。
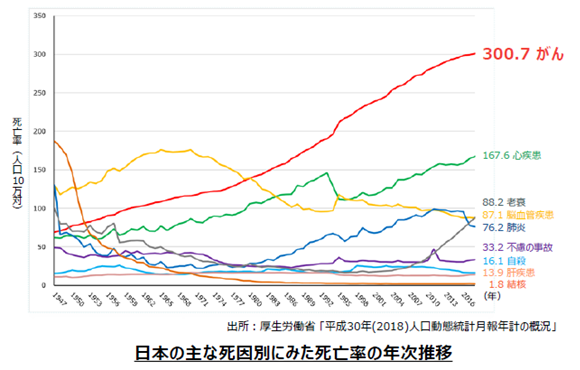
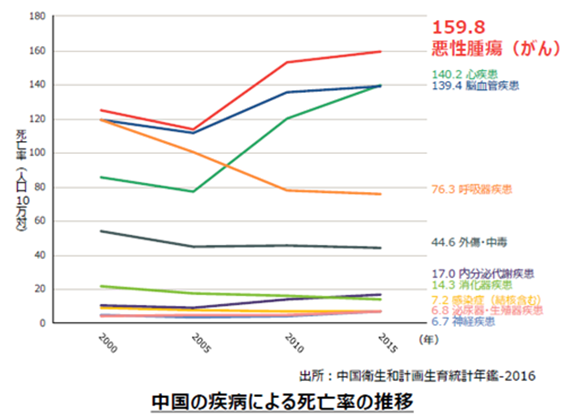
(同社資料より)
こうした中、国別医薬品市場規模は第1位が米国で、中国は日本を抜き第2位となった。世界の医薬品市場は、過去6年間(2010-2016)で約24%増加してきたが、中国市場は、市場全体を大きく上回り約113%増加した。
今後、中国市場は米国市場と1位を分け合う規模まで拡大するとも言われている。
2位中国と3位日本で市場規模は合計23兆円。当面はこの巨大な市場が、同社のメインターゲットとなる。
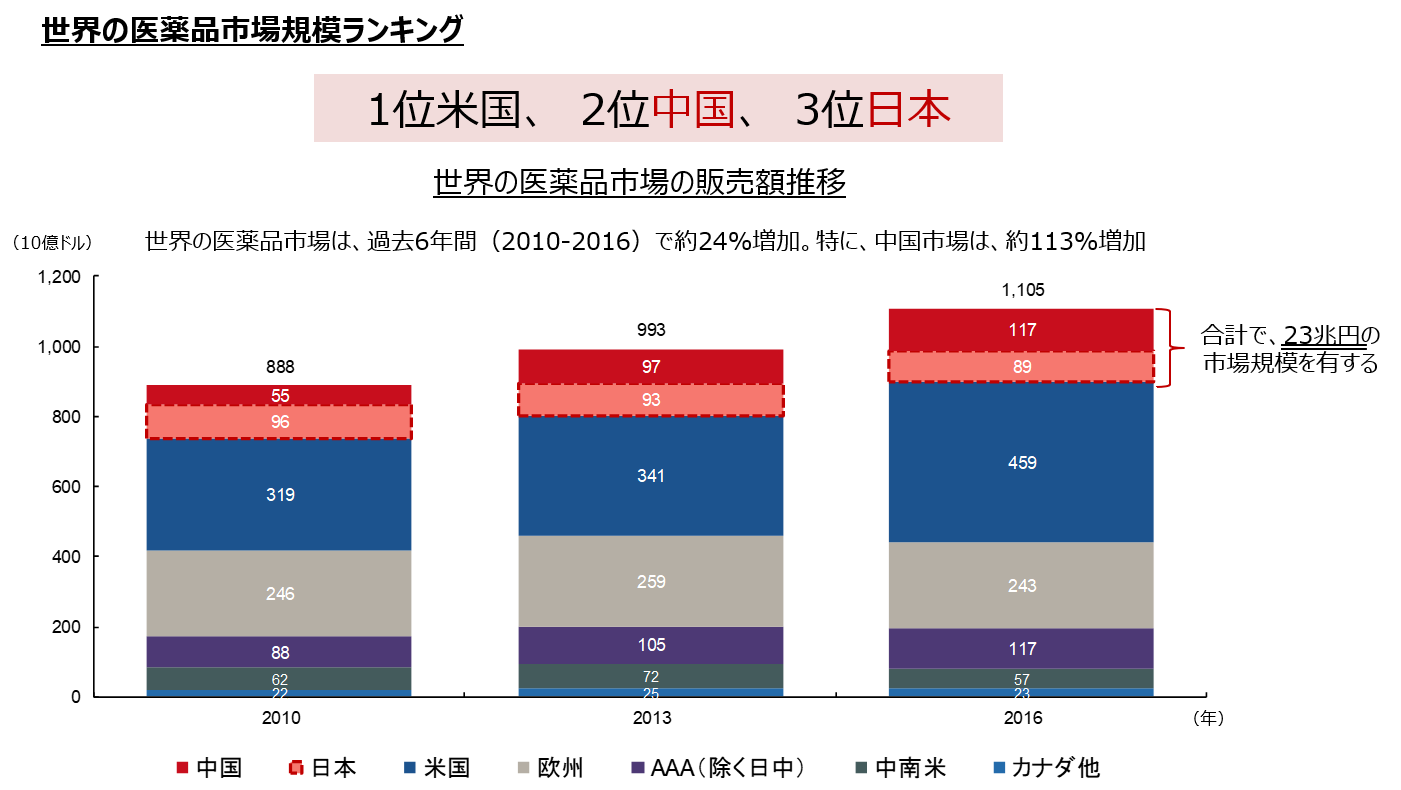
(同社資料より)
また、中国抗がん剤市場は約2兆円で全医薬品市場の約1割を占め、過去5年間CAGR約14%で成長している。
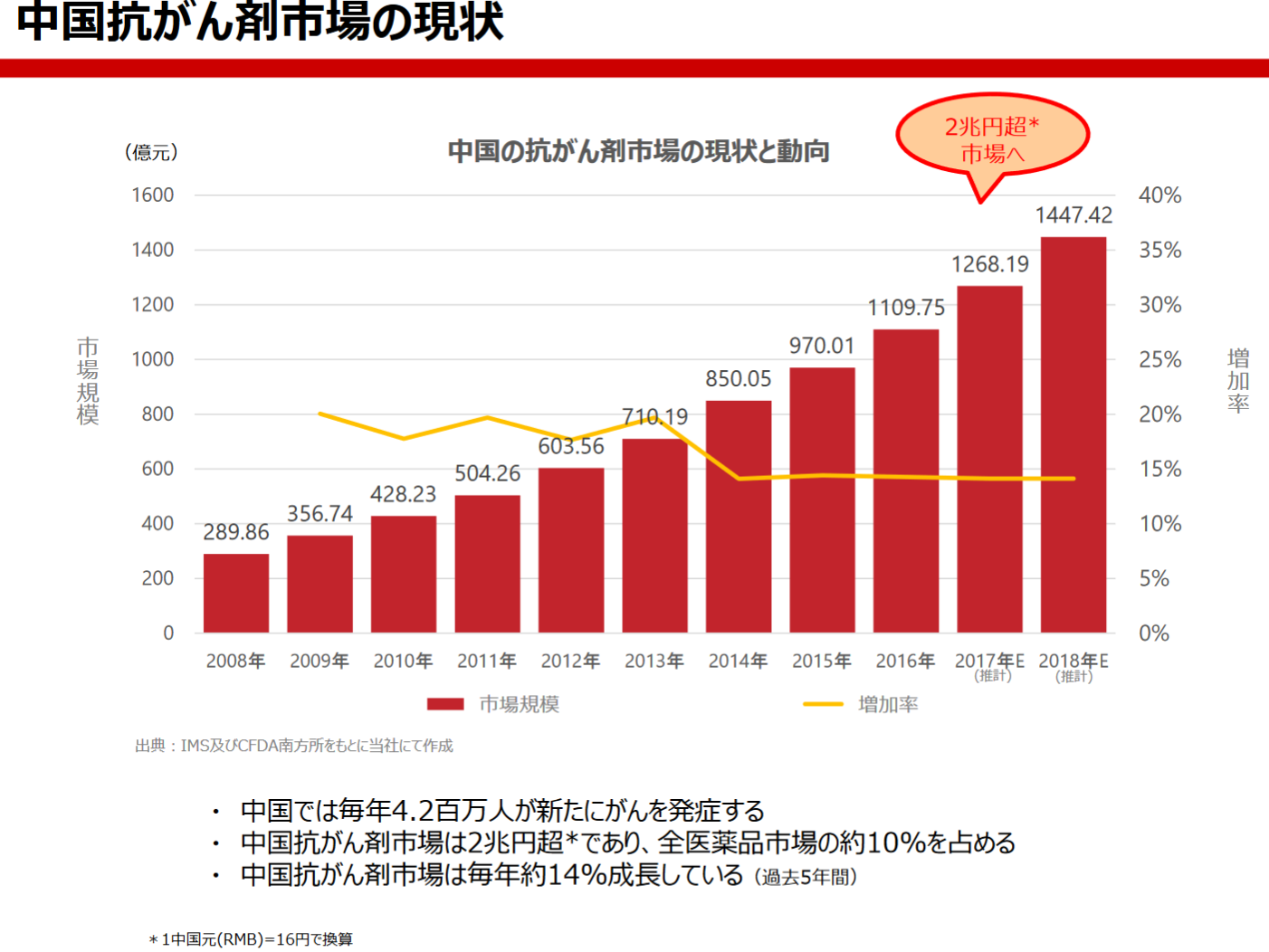
(同社資料より)
こうしたがんによる死亡率の上昇に伴い、世界的に「新規抗がん剤」および「がんサポーティブケア」への期待が高まっている。
(新規抗がん剤)
抗がん剤を用いたがん治療においては、一つの抗がん剤のみを用いる単剤治療よりも、複数の抗がん剤を用いる併用療法のほうが主流である。
加えて、がんは種類によって異なるが、再発の可能性が高く、加えて難治の場合は、一種類の治療での治癒は困難であるため、一つの治療薬が絶対的な存在とはならず、他の治療薬が直接的な「競合」とはなり難いという特性がある。また、近年では、分子標的薬や免疫療法が注目されてはいるが、まだ多くのがん種に対する治療において化学療法剤が重用されている。殺細胞性抗がん剤を含むレジメンは標準治療として位置づけられ、今後も高い医療ニーズが期待される。
(がんサポーティブケア)
抗がん剤はがん細胞を攻撃するなどの強力な医薬品であり副作用が避けられない。
患者に負担がかかる副作用をコントロールできなければ、抗がん剤の減量やがん治療そのものを中止せざるを得ず、結果的には病状が進行してしまうリスクがある。
こうした事態を避け、がん治療を完遂するためには、副作用のコントロールを行うための医薬品や医療機器への期待が高まっている。また、がんの治療薬はがんの種類ごとに承認を得なければならないが、サポーティブケアはがんの種類を問わず、幅広いがん患者への処方が可能であり、大きなニーズ、市場が見込まれる。
以上のように、日本・中国におけるがん治療ニーズの増大とそれに対応した新規抗がん剤およびがんサポーティブケアへの期待は大きく、同社はこうしたニーズを取り込み、収益を拡大させるためのビジネスモデル、事業戦略を構築している。
【1-4 事業内容】
(1) ビジネスモデル
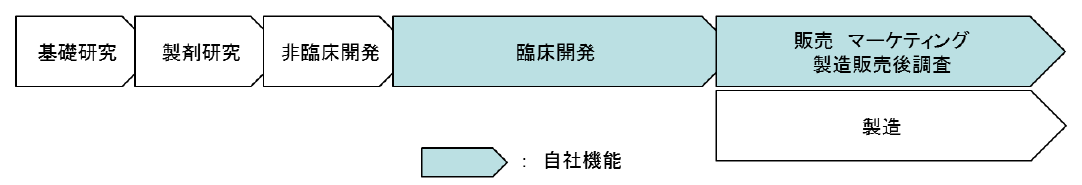
新しい医薬品が上市されるまでには、「基礎研究」から始まり、「製剤研究」、「非臨床開発(動物を用いて薬効薬理作用、生体内での動態、有害な作用などを調べる試験)」、「臨床開発(医薬品や治療技術などの人間への影響を調べる科学的試験)」を経て、当局の承認を得たのち、「製造」、「販売・マーケティング・製造販売後調査」といったプロセスを経るのが一般的である。
大手製薬会社は、巨額な研究開発費を変動費化することなどを目的にCROを利用した臨床開発段階のアウトソーシングを進めてはいるが、基本的には上記の工程全てを自社内に保有している。
これまではこうした体制が製薬会社の高収益体制を支えてきたが、近年の生命科学分野の急速な進歩や複雑化、多様化により、自社固有の創薬技術が陳腐化してしまう可能性が高まっている。
また、多額の費用と時間をかけて基礎研究から進めても臨床開発に入るまでに実用化を断念し、創薬技術を確立できないケースも多く、医薬品開発には常に高いリスクがついてまわる。
そこで同社では、失敗の確率の高い基礎研究から非臨床開発の工程を自社では行わず、まだ開発段階にある将来有望な医薬品を外部から導入して臨床開発から開発に着手。それ以降の事業活動に経営資源を集約することで自社の強みを発揮するとともにリスクの低減を図っている。現時点ではコスト負担の大きい製造工程も保有しない計画である。
(同社資料より)
販売工程については、高収益確保とリスクコントロールのバランスを考慮した仕組みを構築している。
一般的に製薬企業の売上高総利益率は高水準であるが、これは、製造および販売活動を内製化することによって実現できると考えられる。
|
|
売上収益 |
売上総利益 |
売上総利益率 |
|
アステラス製薬 |
1,306,348 |
1,014,299 |
77.6% |
|
第一三共 |
929,717 |
565,112 |
60.8% |
*単位:百万円。19年3月期実績。
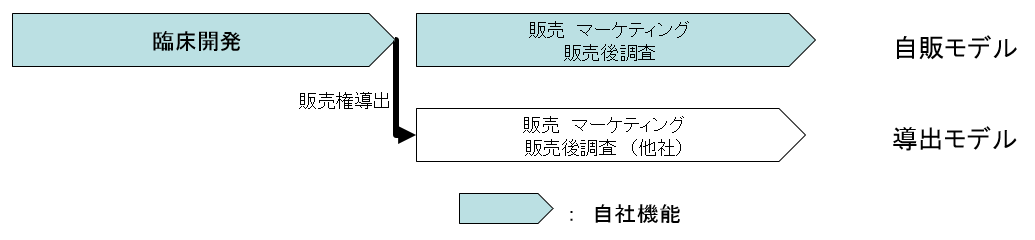
一方医薬品は販売地域の網羅性(例:日本全国をカバー)が要求され、自社販売網を構築しようとすれば、固定費が増大する。そこで同社では、臨床開発を終えた医薬品について、「自販モデル」と、販売権を他社に導出する「導出モデル」を併用している。
(同社資料より)
(導出モデル)
現在の主な導出先パートナーは以下の3社である。
|
Meiji seika ファルマ株式会社 |
*明治グループの医薬品会社。がん、感染症、中枢神経系領域におけるスペシャリティ・ファーマ。多数のがん領域製品の販売実績を有している。 |
|
*「ダリナパルシン (SP-02)」 日本権利パートナー |
|
|
*「エピシル® (SP-03)」 日本権利パートナー |
|
|
Lee’s Pharmaceutical (HK) Limited |
*香港市場上場の中国系製薬会社。中国全土約30拠点を通じがん領域をはじめ、多数の医薬品の販売を行っている。 |
|
*「Sancuso® (SP-01)」 中国権利パートナー(北京・上海・広州以外の中国) |
|
|
*「エピシル® (SP-03)」 中国権利パートナー(北京・上海・広州以外の中国) |
|
|
マルホ株式会社
|
*1915年創業の医療用医薬品等の研究・開発・製造・販売を行う製薬企業。特に皮膚科学領域で強みを有する。 *「PledOx® (SP-04)」の日本権利パートナー |
今後も共同歩調が取りやすくWIN-WINの関係を構築できる中堅製薬メーカーを中心に導出先パートナーとして確保していく考えだ。
(2)中国におけるマーケティング体制
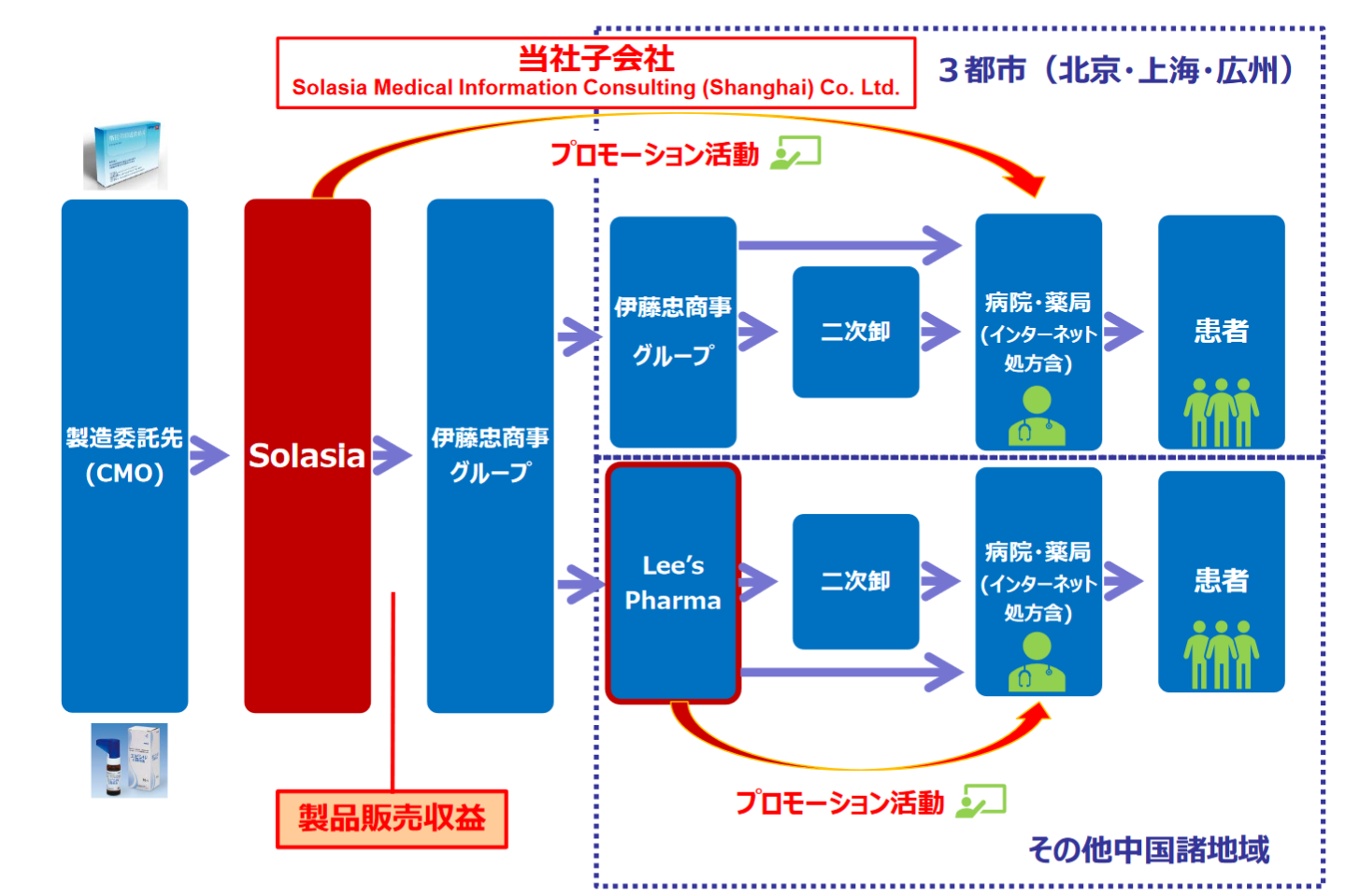
巨大な中国医薬品市場の開拓を目指す同社は、中国の3大都市「北京・上海・広州」においては製品販売利益の最大化と固定費管理を念頭に、自社販売体制を構築し自販モデルを展開していく。
中国での自販活動は、100%子会社であるSolasia Medical Information Consulting (Shanghai) Co. Ltd.が担当する。
この3都市の人口合計は中国全人口の約5%に過ぎないが、抗がん剤を取り扱うのは最先端かつ大病院であるため、大病院が集中するこの3都市は中国の抗がん剤市場の3割を占める巨大マーケットである。
また、新しい医薬品の使用・普及にあたっては影響力のある医師の判断や決定がその結果を大きく左右する。こうした影響力のある医師の在籍する大病院への営業活動は極めて重要なポイントとなる。
加えて、中国全土ではなくあくまでもそれぞれの都市における営業であり、少人数の営業組織でも十分に活動は可能である。
ポイント①経験豊富なマネジメントチーム
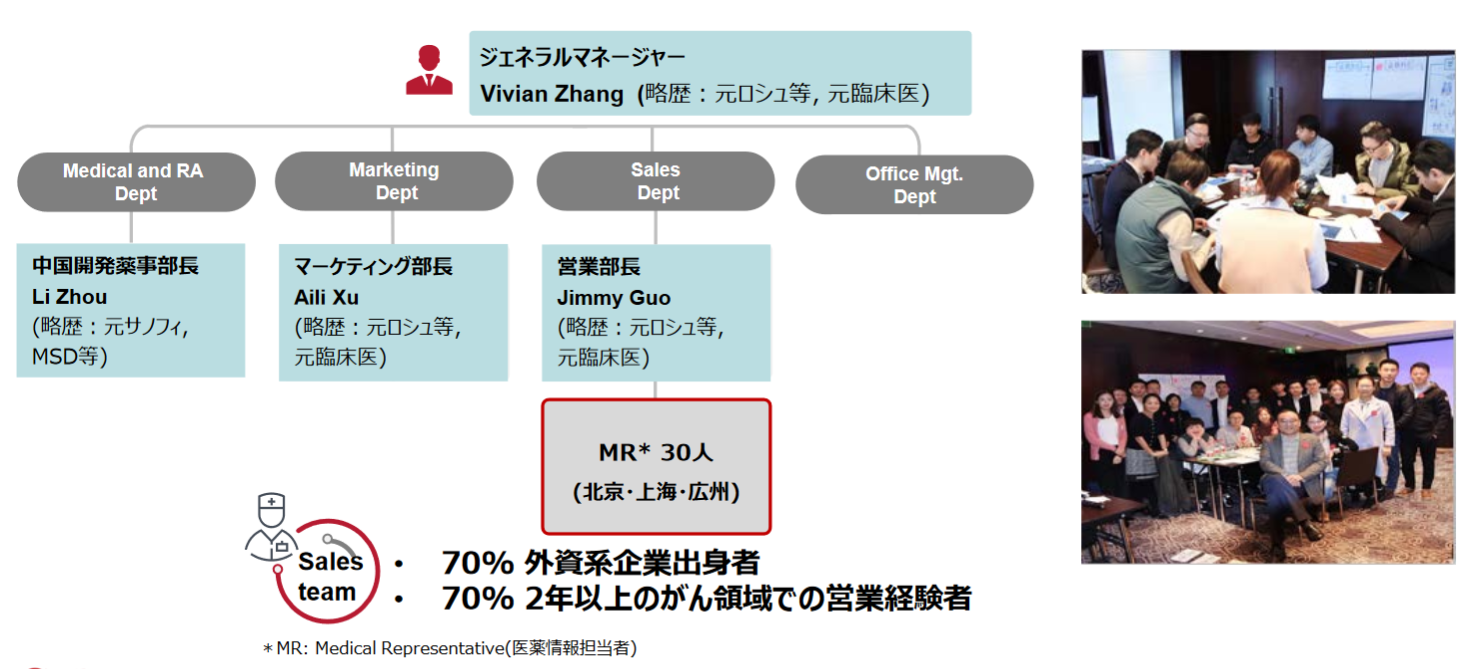
2014年に設立された中国における自社マーケティングを担当する100%子会社Solasia Medical Information Consulting (Shanghai) Co. Ltd.は以下4名の責任者がリードしている。
(同社資料より)
|
役職 |
氏名 |
経歴など |
|
中国事業General Manager |
Vivian Zhang |
元Roche中国癌領域事業部長等、医師(元上海第二医科大学付属第九人民病院) |
|
中国子会社マーケティング部長 |
Aili Xu |
元Roche, BMS, Sanofi等、医師(元上海第一人民病院救命救急) |
|
中国子会社営業部長 |
Jimmy Guo |
元Roche, BI等、医師(元蘇州市立医院心臓外科) |
|
中国開発薬事部長 |
Li Zhou |
元サノフィ、MSD |
子会社の社長にあたるVivian Zhang氏は臨床医として4年間大学病院に勤めた後、26年間製薬会社に勤務し、主にがん分野で豊富な経験を積んできた。中でも、世界的製薬企業ロシュ社においてはハーセプチン(抗悪性腫瘍剤)、タルセバ(抗悪性腫瘍薬)、アバスチン(抗悪性腫瘍剤)といった抗がん剤史上に名を残す有力抗がん剤の他、抗がん剤治療における副作用を抑制する制吐剤カイトリル(グラニセトロン塩酸塩)などで優れた販売実績を上げ、抗がん剤事業の責任者を務めた。
また、Aili Xu氏、Jimmy Guo氏、Li Zhou氏もメガファーマ出身で豊富な経験を有している。
こうしたエキスパートの下、上海、北京、広州に各10名程度、合計30名程度のMRを採用しているが、その7割が大手外資系製薬会社の出身でかつ、平均2年以上のがん分野でのセールス経験者である。
経験豊富なマネジメントチームの下、強力なマーケティング・販売部隊を運営している。
ポイント②中国医学界から高評価
新しい医薬品の使用・普及にあたっては影響力のある医師の判断や決定がその結果を大きく左右するが、中国もその例外ではない。
そうした状況の中、「Sancuso® (SP-01)」は臨床現場で参照されるがん治療に対する中国版NCCNガイドラインにおいて、既に悪心嘔吐の標準治療の一つとして推奨されている。
また、CSCO(中国臨床腫瘍学会)において中国のがん治療分野をリードする著名な臨床医が、「Sancuso® (SP-01)」について簡便にかつ化学療法全プロセスにおいて悪心・嘔吐を抑制する点を高く評価していることを受けて、CSCOが初めて発行した制吐薬適正使用ガイドラインにおいて、がん治療時の標準的な制吐療法の選択肢として「Sancuso® (SP-01)」が収載された。
こうした高評価を受けることができているのは「Sancuso® (SP-01)」自体の優れた効能はもちろんであるが、マネジメントチームがRoche時代から構築してきた中国臨床ネットワークとの強固なリレーションシップが大きな役割を果たしていることは明らかであり、他のバイオベンチャーにはない同社の大きなアドバンテージである。
ポイント③マーケティング活動の現在と今後
「Sancuso® (SP-01)」および「エピシル® (SP-03)」販売に向けた同社の当面の自販体制構築は、3都市での拠点設置、30名のMR採用により完了したということだ。
今後は影響力の大きい医師が在籍する3都市、70以上の大病院を中心にカバーし、そこを起点とした情報伝播による販売拡大を推進していく。
まず各病院若しくは病院付属薬局、一般薬局において口座を開設する必要があるが、現在まででこれらのターゲットの約半数で口座を開設している。両製品ともまだ保険収載されていないことから、販売額はややスローな立ち上がりだが、今後は口座開設が進むとともにスピードアップが期待できるということだ。
なお、その他中国諸地域における「Sancuso® (SP-01)」および「エピシル® (SP-03)」の販売は、販売契約締結先のLee’s Pharma社が行う。
(同社資料より)
(3)製品・開発パイプライン
現在、前述の経営方針に沿って以下4つの製品・開発パイプラインを有している。
パイプラインの開発・事業化の経緯、現状、今後の計画は以下のとおり。(2019年11月13日現在)
加えて、2020年6月までを目途として、がん治療薬及びがんサポーティブケア等の複数の医薬候補品から新規導入対象の選定を現在進めており、選定完了および導入実現後は、新規パイプライン「SP-05」としてその後の開発を進めていくこととしている。
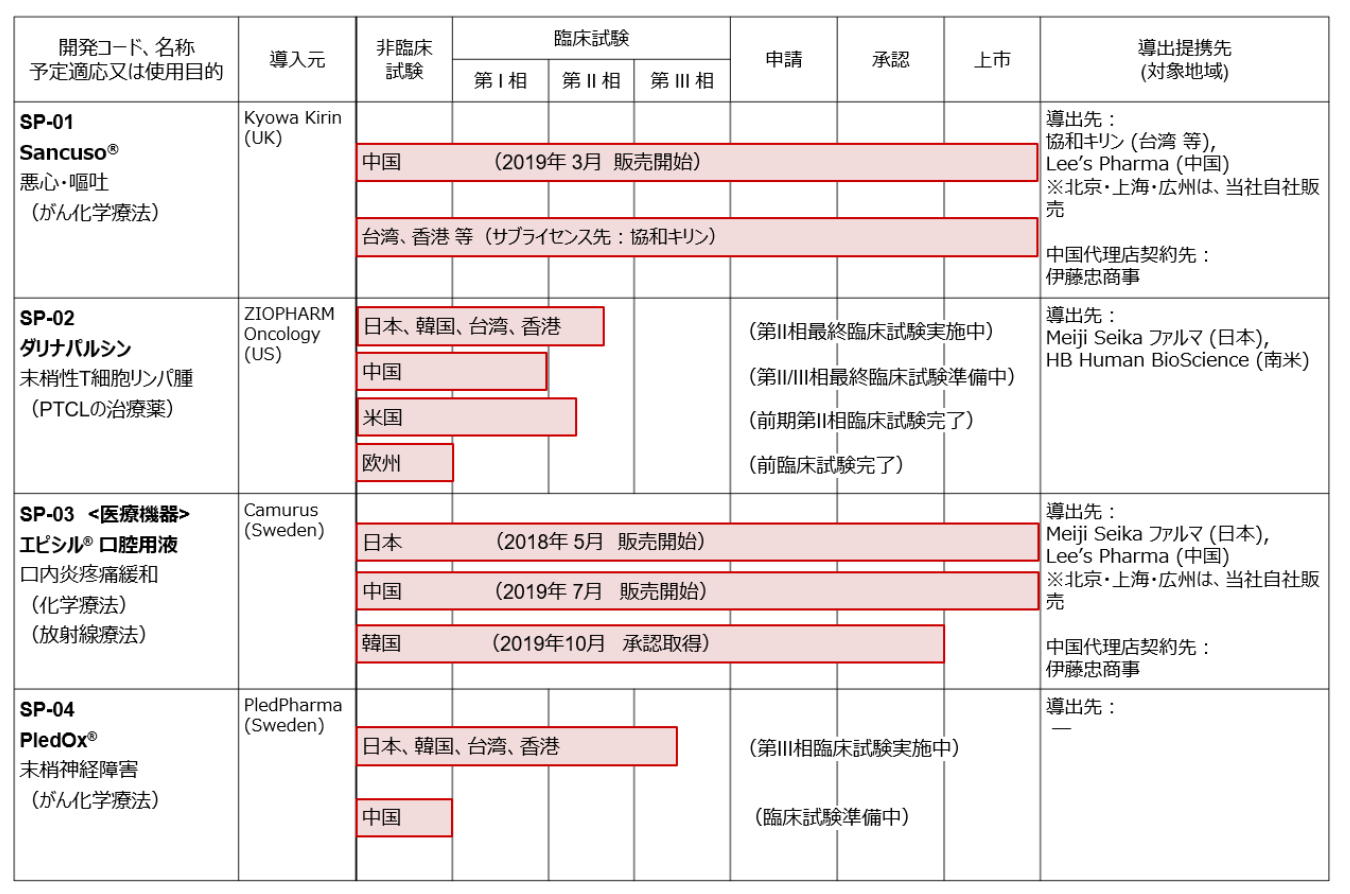
(同社資料より)
①「SP-01:経皮吸収型制吐剤 Sancuso®」(中国販売名:善可舒®)
|
項目 |
|
概要 |
|
|
効能・効果 |
|
がん化学療法による悪心・嘔吐 |
|
|
特徴・競合薬比較 |
* |
世界で唯一の経皮吸収型5HT3受容体拮抗剤 |
|
|
* |
1回の投与(貼付)で5日間効果が持続することから、通常の化学療法(1~5日投与)の投与期間をカバーすることができる。外来使用も可能。 |
||
|
* |
2019年6月(上市3ヶ月後)、中国臨床腫瘍学会(CSCO)※発行初回ガイドラインに、がん治療時の標準的な制吐療法の選択肢として新たに収載 |
||
*CSCO(Chinese Society of Clinical Oncology) : 中国における最大且つ最も権威あるがん関連学会
◎対象疾病の概要
抗がん剤の代表的な副作用として悪心や嘔吐はよく知られている。
抗がん剤を投与すると、小腸にあるクロム親和性細胞と呼ばれる細胞がダメージを受ける。
ダメージを受けたクロム親和性細胞はセロトニンという神経伝達物質を放出。これが末梢の迷走神経上にある5-HT3受容体に取りこまれ、その刺激が末梢の迷走神経に沿って、脳の第4脳室最後野にある化学受容器引金帯(CTZ)を介して延髄に入り、悪心・嘔吐の命令を生体に出す嘔吐中枢を刺激し、悪心や嘔吐が発現する。
悪心・嘔吐を抑制するためにはセロトニンによる5-HT3受容体への刺激を遮断することが必要であり、そのために用いられる薬剤「5-HT3受容体拮抗薬」としては様々なものがあるが、代表的な薬剤がグラニセトロンである。
◎「Sancuso® (SP-01)」概要
「Sancuso® (SP-01)」は、このグラニセトロンを含んだ5-HT3受容体拮抗薬の経皮吸収型製剤(貼付剤)で、貼り薬としては世界唯一。
|
 |
 |
 |
|
(中国販売用パッケージ) |
|
|
(同社資料より)
抗がん剤は5日間にわたり投与するケースが多いが、注射や経口による制吐剤は概ね1~2日間しか効果がなく、抗がん剤投与期間内に複数回注射しなければならない。これに対し「Sancuso® (SP-01)」は5日間にわたって安定的に血中のグラニセトロン濃度を維持することができるため、1回貼り付ければ制吐剤を追加する必要がなく、入院ではなく外来によるがん治療を可能とするため、患者のQOL向上にも大きく貢献する。
悪心・嘔吐、口内炎などが原因で、薬剤の服用が困難な状態にある場合でも、経皮吸収型製剤は使用可能である点も大きなメリットであり、以上のような点を評価され、米国NCCN診療ガイドライン、中国治療ガイドラインで処方推奨を得ている。
◎開発および販売状況
現在、米国、欧州、韓国等(導入元及び同社サブライセンス先の協和キリン等が販売)の20以上の国と地域で上市されている。今後は、がん化学療法だけでなく放射線療法による悪心・嘔吐抑制への適応拡大を見込んでいる。
中国では2014年6月の承認申請完了を経て、18年7月に承認および市販用製剤の輸入許可を取得。これを契機に18年12月期第3四半期にはマイルストンを受領し売上収益を計上した。
その後、市販用製品の製造工程が確立し、初回出荷の対象となる製品製造が完了したことを受け、18年11月、中国販売代理店契約を締結している直接的な販売先である伊藤忠商事向けに出荷を開始した。
その後、中国通関の諸手続も完了し、予定通り2019年3月、販売を開始した。
北京市・上海市・広州市においては自販組織により、他の中国諸地域においては販売権導出先であるLee’s Pharma社を通じて販売活動を行う。
中国主要臨床医の評価コメント
販売開始にあたり、2019年3月16日、同社は「Sancuso®上市セミナー」を上海で開催(共催)した。
CSCO(Chinese Society of Clinical Oncology:中国臨床腫瘍学会)の理事長であるLi Jin教授、副理事長であるQin Shukui教授及びMa Jun教授を議長とし、中国全土から総勢約200名のがん専門医が一同に会した同セミナーにおいて、中国主要臨床医は以下のようなコメントを述べ、「Sancuso® (SP-01)」を評価している。
Qin Shukui教授(CSCO副理事長)
「制吐剤を処方しなければ、がん化学療法の患者の70-80%において、CINV(がん化学療法による悪心・嘔吐)が生じることとなる。悪心・嘔吐が重症な場合は、化学療法の薬剤投与を減量するか中止しなければならず、治療結果に対して悪影響を招く。従来、中国では、CINV予防として主に効果発現時間の短い注射剤が使用されてきた。注射剤は血中濃度が大きく変動するため、繰り返し投与する必要があり、患者にとって利便性が低い。Sancuso®はグラニセトロンを最長7日間、毎日持続的に放出するよう設計された独自の経皮吸収型製剤であり、化学療法1サイクルに対し1枚の使用で効果が期待できるため、化学療法を受ける患者にとって新しい非侵襲性の選択肢となるだろう。」
Ma Jun教授(CSCO副理事長)
「高度および中等度催吐性の化学療法を受けている患者における悪心・嘔吐リスクは、化学療法を受けた後2~3日間続くことになる。数日間にわたる化学療法では、急性悪心・嘔吐と遅発性悪心・嘔吐が重複することとなり、それに対してより安定した長期持続性のCINV治療薬が必要となる。Sancuso®は想定される急性および遅発性の悪心・嘔吐を含む様々な段階をカバーすることが可能であり、7日間の安定した有効性は、化学療法全プロセスでのCINV管理を可能にし、患者は安心して化学療法を受けることができるようになるだろう。」
Li Jin教授(CSCO理事長)
「Sancuso®は、中国において化学療法を受ける患者の悪心・嘔吐予防の新しい非侵襲性の選択肢となるだろう。投与は貼付剤ゆえに簡単で、且つ長時間効果が持続するため、化学療法全プロセスでのCINV管理が容易となり、CINVの治療効果を向上させるだろう。」
CSCOとして初となる制吐薬適正使用ガイドラインを発行
上市3か月後となる2019年6月、CSCOが初めて制吐薬適正使用ガイドラインを発行し、がん治療時の標準的な制吐療法の選択肢として「Sancuso® (SP-01)」が収載された。
ガイドライン編集委員長でCSCO副理事長のQin Shukui教授は、「高度/中等度催吐性リスク抗がん剤に対する制吐療法として、本ガイドラインではSancuso®を推奨する。化学療法を受ける患者にとって新しい非侵襲性で且つ安全な選択肢となる。」とコメントしている。
同社では「Sancuso® (SP-01)」の特徴や競合薬に対する優位性にかかるKey Opinion Leaderと呼ばれる臨床医の評価の獲得、医療現場の臨床医への知見提供という上流・下流2方向の営業活動を展開。
数量ベースで6%成長し、800億円以上といわれる中国5-HT3 RA制吐剤市場でのシェア獲得を目指している。
②「SP-02:新規化学療法剤 darinaparsin(ダリナパルシン)」
|
項目 |
|
概要 |
|
対象疾病 |
|
再発・難治性の末梢性T細胞リンパ腫(PTCL) |
|
特徴・競合薬比較 |
* |
欧州では未だPTCL適応での承認薬はない(日・米は3種承認済) |
|
* |
日・米で承認されている製品と比較して、重い副作用(骨髄抑制、口内炎)が報告されておらず、安全性が高く長期間投与或いは併用投与も期待できる |
(対象疾病の概要)
悪性リンパ腫は、血液がんの1つで、白血球の中のリンパ球ががん化したもの。
リンパ球には、B細胞、T細胞、NK細胞等の種類があり、これらががん化して無制限に増殖することで発症する。
末梢性T細胞リンパ腫(PTCL:Peripheral T-cell lymphoma)とは、悪性リンパ腫の種類の1つ。リンパ球の中のT細胞から発生するもので、月単位で病気が進行する「中悪性度」に分類され、中悪性度リンパ腫の10~15%を占めるといわれている。B細胞リンパ腫などに比べ、5年生存率は低く、25%前後である。
(開発および販売状況)
「ダリナパルシン (SP-02)」は、この再発・難治性の末梢性T細胞リンパ腫(PTCL)への適応で開発をスタートさせた。
2015年10月までに米国や日本、韓国等で187名の被験者に投与される実績を有する。
米国における前期第Ⅱ相臨床試験は2012年4月に完了し、白人種における一定の有効性を確認した。
2015年4月に完了した日本および韓国における第Ⅰ相臨床試験では、PTCL患者において安全性及び忍容性が確認され、アジア人種における一定の有効性が示唆された。
日本、韓国、台湾、香港で2016年にスタートした最終試験として位置づけられるアジア国際共同第Ⅱ相臨床試験は再発又は難治性の末梢性T細胞リンパ腫患者65名(計画ベース)を対象に進行中であったが、2019年9月、患者登録は目標症例数に到達した。今後は、2020年に統計解析を経た試験結の公表を予定しており、その結果が良好な場合には当局との最終協議を経て、承認申請に移行する計画だ。
中国においては最終試験である第Ⅱ相臨床試験の準備中である。
悪性リンパ腫はしばしば再発することが知られており、作用機序の異なる複数の治療薬が必要でマーケットは大きいと同社は考えている。
末梢性T細胞リンパ腫のみでなく、その他血液がん(リンパ腫、白血病)や固形がんへの適応拡大を目指しており、現在、非臨床試験も並行して実施している。
日本での開発販売権はMeiji Seika ファルマ株式会社に導出済で、2018年8月には、コロンビア共和国のHB Human BioScience SAS社と、コロンビア、ペルー、エクアドル、ベネズエラ、チリ、パナマ、コスタリカ及びグアテマラでの販売等の独占的権利を導出した。
同社は「ダリナパルシン (SP-02)」の全世界権利を有しており、今後、米国、欧州等の地域を対象とした権利導出を積極的に展開する計画で、多くの引き合いが来ているという。
➂「SP-03:医療機器 エピシル® 口腔用液」
|
項目 |
|
概要 |
|
使用目的 |
|
化学療法や放射線療法に伴う口内炎で生じる口腔内疼痛の管理及び緩和を物理的作用により行う。カテゴリーは医療機器。 |
|
特徴・競合薬比較 |
* |
がん等の化学療法や放射線療法による口内炎に対する標準的対処法はなく、病院毎での対症療法に頼っており、新しい対処法が強く求められている。 |
|
* |
薬効成分を含まないため副作用がなく、抗がん剤との相互作用もない。 |
(対象疾病の概要)
抗がん剤による悪心・嘔吐と並んで、がん化学療法又は放射線療法による口腔粘膜障害の副作用も患者にとっては大きな困難である。
口内炎は、「化学療法が口腔粘膜へ直接作用して障害が生じるもの」や「放射線照射により唾液腺組織に障害が生じ、唾液の分泌低下により口腔内の自浄作用が低下し局所感染が起こることで発生するもの」である一次口内炎と、「白血球減少などに伴う骨髄抑制により起こる口腔内感染が原因となるもの」である二次口内炎がある。
抗がん剤治療に伴う口内炎の発生頻度は30~40%、抗がん剤と頭頸部への放射線治療併用時の口内炎発生頻度は約100%となっている。
がん化学療法又は放射線療法による口内炎は、300~500もの多数の炎症が発生するものもある。その疼痛により患者は食事や水分の経口摂取が困難になり体力低下を招き、重症化すると本来のがん治療の継続にも悪影響を及ぼしてしまう。これまでは確立した標準治療はなく、病院ごとでの対症療法が主流であったため。
(「エピシル® (SP-03)」概要)
「エピシル® (SP-03)」は、脂質ベースの液体を口腔粘膜に滴下塗布するものであり、同社ではカテゴリーとしては医療機器として開発を進めてきた。
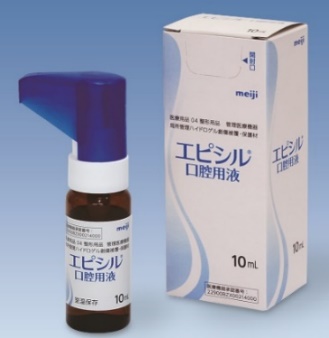
(同社資料より)
口腔粘膜に適量を適用すると、数分以内に液体が口腔内の水分を吸収し生体接着ゲル化し、物理的なバリヤーを形成するもので、8時間程度の口内炎の疼痛緩和効果が臨床的に示されている。
(開発および販売状況)
2016年に日本における承認申請を完了していたが、2017年7月6日付けで、厚生労働省より、日本国内における医療機器製造販売承認を取得した。2018年1月には第388回中央社会保険医療協議会総会において18年4月からの保険適用が承認され、保険収載(7,520円/本、10ml入:2018年4月時点)を経て、18年5月、日本における独占販売権の導出先であるMeiji Seika ファルマ株式会社による販売が開始された。
中国においても2016年5月の承認申請後、2019年2月、医療機器輸入販売承認を取得したのを受けて、2019年7月に販売を開始した。
北京、上海、広州では自社が、その他の中国地域については販売権導出先のLee’s Pharma社が販売活動を行う。
同社では、「エピシル® (SP-03)」の商品特性から、既存市場を開拓するのではなく「市場を創出する」というスタンスで事業を展開する。
日本・中国で200~300億円のマーケットを想定しており、30~50%のシェア獲得を目指す。
韓国においては2018年8月、導入元であるCamurus AB社と韓国での独占開発販売権利を導入する契約を締結し、2019年3月、当局へ承認申請を行っていたが、同年10月韓国における医療機器輸入販売承認を取得した。
販売については、販売権導出契約に基づく販売を検討しており、現在、複数の韓国企業と交渉を行っている。
日本・中国・韓国以外では、米国、英国、ドイツ、デンマーク、ノルウェー、スウェーデン、フランスなどで他社及び導入元等により販売されている。
④「SP-04:細胞内スーパーオキシド除去剤 PledOx®(プレドックス)」
|
項目 |
|
概要 |
|
対象疾病 |
|
がん化学療法に伴う末梢神経障害 (Chemotherapy Induced Peripheral Neuropathy:CIPN) |
|
特徴・競合薬比較 |
* |
がん化学療法に伴う末梢神経障害に対する承認医薬品は存在しない。 |
|
* |
生体に悪影響を及ぼす細胞内活性酸素の一種スーパーオキシドを分解する酵素スーパーオキシド・ジスムターゼ様の作用を持つ新規に化学合成された金属複合体(キレート)。 |
先行する3つの開発がおおむね順調に進む中、4つ目のパイプライン導入を上場時から検討していた同社は、「がん領域である。」、「臨床試験が一定程度進んでいる。」、「日本及び中国での開発権利を獲得できる。」という3つの条件を満たす新薬を探していた。そして、2017年11月にスウェーデンのPledPharma AB(以下、「Pled 社」)から、がん化学療法に伴う末梢神経障害薬「PledOx®」の日本、中国、韓国、台湾、香港及びマカオでの開発事業化の独占的権利を獲得した。早期の承認取得を実現するため、まず大腸がん治療における代表的な抗がん剤「オキサリプラチン」投与による末梢神経障害に適応を絞り、日本や中国など東アジア地域での臨床開発を進めていく。
(対象疾病の概要)
がん化学療法は、悪心・嘔吐や口内炎発症等の副作用が生じるが、末梢神経障害(CIPN)も重篤な副作用の一つ。CIPNは、プラチナ製剤やタキサン製剤等のがん化学療法の主要薬剤において、顕著に発現することが知られている。
大腸がんのうち手術による治癒が難しい進行・再発がん(ステージⅢ、Ⅳ)に対する化学療法及び術後補助化学療法における代表的な治療法であるFOLFOX療法は、フルオロウラシル・フォリン酸・オキサリプラチンの 3 剤を併用するものだが、このうちオキサリプラチンの処方は、患者の約9割で「手、足や口唇周囲部等の異常感覚」、「呼吸困難や嚥下障害を伴う咽頭喉頭の絞扼感(しめつけ)」、「手足先のしびれ」、「感覚低下」、「感覚性運動失調」などの症状を伴うCIPNを生じさせる。
このような副作用が発現した場合には、薬剤中止により、80%の症例では一部症状の改善がみられ、40%の症例では 6~8 ヵ月後には完全に回復するが、薬剤中止はがん化学療法の中止や方針変更となる可能性があり、CIPNの治療は医療上の重要な課題である。ただ、がん化学療法の副作用としての末梢神経障害を適応として当局に承認された医薬品は現時点では存在していない。
(「PledOx® (SP-04)」概要)
「PledOx® (SP-04)」の導入元Pled社はストックホルム証券取引所に上場しており、酸化ストレス関連の疾患に対する医薬品開発に強みを持つ。「PledOx®」(有効成分名:calmangafodipir)は欧米で販売実績を有するMRI造影剤「Mangafodipir」を基に創生された新有効成分である。
「PledOx® (SP-04)」はCIPN薬の開発トップランナーであり、開発成功は大きな先行者利益獲得につながるだけでなく、がん患者のQOL向上など社会的貢献度も高い。
*市場性
ソレイジア・ファーマによれば、FOLFOX療法の対象となる大腸がん患者数は年間で日本6~10万人、中国20万人程度と推定している。
FOLFOX療法は、「3日間の治療、11日間の休薬期間」の計14日間が1サイクルであり、それを12サイクル行う治療法である。対象疾患はオキサリプラチン投与を含むがん化学療法の対象となる大腸がんであるが、オキサリプラチン以外のプラチナ製剤やタキサン製剤等のがん化学療法の主要薬剤においてもCIPNが顕著に発現することが知られており、乳がん、肺がん、卵巣がん、膵臓がんなど大腸がん以外の固形がんも追加対象疾患となれば、市場性は更に広がると同社は想定している。
(開発および販売状況)
Pled社は、これまでCIPNを適応として PledOx®の研究開発を欧米で行ってきており、後期第Ⅱ相臨床試験までの結果、FOLFOX療法を受けている進行性大腸がん患者において、有効性と安全性、つまりCIPNを改善する効果およびFOLFOX 療法によるがん治療そのものへの影響を生じさせないこと等についての効果が示唆されている。
Pled 社は、日本への導出を検討した際、日本人を対象とした臨床試験が必要と判断したため米国で日本人を被験者とするPledOx®の第Ⅰ相臨床試験を実施してきたが、18年2月、この第Ⅰ相臨床試験は終了し、「PledOx® (SP-04)」の日本人における良好な安全性及び忍容性が確認された。
一方Pled 社は、18年11月に、FDA(米国食品医薬品局)及び EMA(欧州医薬品庁)との協議を経た第Ⅲ相国際共同臨床試験を開始した。
日本人を被験者とする第Ⅰ相臨床試験が終了したソレイジア・ファーマは、2018年6月、独立行政法人医薬品医療機器総合機構(PMDA)との協議を経て、第Ⅱ相臨床試験実施を回避してソレイジア・ファーマの権利地域である日本、韓国、台湾、香港での当該第Ⅲ相国際共同臨床試験への参画を決定し、同年12月に最終試験となる同臨床試験を開始した。
被験者登録は順調に推移しており2020年の終了、2021年の結果発表を見込んでいる。
試験の概要は以下の通り。
|
試験相等 |
第Ⅲ相・国際共同試験、多施設共同・二重盲検・無作為化・プラセボ対照試験(※) |
|
試験目的 |
「PledOx® (SP-04)」投与による、オキサリプラチン投与に伴う末梢神経障害の発現抑制効果を、プラセボと比較して検証する。 |
|
試験構成 |
(POLAR-M試験) FOLFOX療法を実施する遠隔転移を有する大腸がん(結腸がん・直腸がん)患者を対象とする。 (POLAR-A試験) 術後補助化学療法としてFOLFOX療法を実施する大腸がん(結腸がん・直腸がん)患者を対象とする。 |
|
主要評価項目 |
POLAR-M試験及びPOLAR-A試験共に、「PledOx® (SP-04)」の初回投与(FOLFOX療法の第1サイクル1日目)から9か月後における、中等度以上の慢性末梢神経障害を有する患者の割合を評価する。 |
|
目標症例数 |
(POLAR-M試験) 420症例 (Pled社との共同開発) (POLAR-A試験) 280症例 (Pled社との共同開発) |
*プラセボ対照試験薬の臨床試験において、被験者を対照群と治療群とに分け、対照群にはプラセボを割り付ける試験。 プラセボとは色、重さ、味及び匂いなどを可能な限り被験薬に似せ、かつ薬効成分を含まない「偽薬」。
最終試験である第Ⅲ相国際共同臨床試験が開始されたことで、「PledOx® (SP-04)」の事業化はさらに前進した。
ソレイジア・ファーマでは、今後中国における臨床試験を予定しているほか、日本、アジアでの権利導出を検討中である。
最終試験が順調に進む中、ソレイジア・ファーマは、オキサリプラチン以外のがん化学療法に起因する末梢神経障害への対象拡大は、臨床現場におけるアンメット・メディカルニーズに応えると共に「PledOx® (SP-04)」の事業規模拡大に貢献するものと判断し、2017年11月にPled社と締結した「PledOx® (SP-04)導入契約」を2019年10月に更新し、共同で対象拡大のための開発を推進する方針について合意した。
今回の契約更新によって、日本、中国、韓国、台湾、香港及びマカオにかかるソレイジア・ファーマの権利地域に変更はない。当初の契約によって定められていた経済条件のうち、契約金、開発進捗及び一定の売上高達成に応じ同社がPled社に対して支払うマイルストン合計の上限額は93億円から18億円増加し111億円となるが、売上高に応じて支払う ロイヤリティの料率には変更はない。なお、今回の契約更新による収益拡大、そのための開発投資やこれら経済条件の変更の主な影響は長期に及ぶものと想定され、今期業績予想への影響はなない。
加えて、2019年12月、マルホ株式会社(大阪府大阪市)と「PledOx® (SP-04)」の独占的日本国内販売権の導出契約を締結した。
この契約の経済条件は、「マルホはソレイジア・ファーマに契約一時金10億円を支払う」、「マルホはソレイジア・ファーマに今後の開発及び販売の進捗に応じたマイルストン最大総額約180億円の支払を行う」、「ソレイジア・ファーマはマルホに対してPledOx® (SP-04)を独占的に販売する」というもの。
【1-5 バイオベンチャーとしての6つの特徴】
バイオベンチャーとしての同社を特徴づけるのは主に以下の6点である。
➀創業の経緯
同社のスタートは、伊藤忠商事と米国のバイオに特化したVCであるMPMキャピタルによって設立された「JapanBridge (Ireland) Limited」。数社のバイオベンチャーから新薬の権利を導入し、開発を進めた。
当初はExitとして製薬会社への売却を中心に考えていたが、事業の将来性、有望性から企業として永続的に事業を展開する方向にシフトし、研究開発に向けた資金調達も必要なため株式公開の道を選択。その後、2017年3月に株式公開を果たした。もともと他社への売却を念頭に置いていたことから、保有する開発品は開発段階ではあっても他社に売却して現金化可能な優良な資産で構成されており、創業時より既に強固な事業基盤を構築している。
➁実務経験豊富な臨床開発陣
研究部門や前臨床部門を持たず、新薬開発の権利導入を活用し、臨床開発以降の医薬品創造プロセスに特化している。医薬品事業化への研究開発過程において最も大切なのは最終的に当局の承認を取得することであるが、そのためには臨床開発、特に第Ⅱ相以降の後期臨床段階におけるスキルやノウハウが最も重要である。
数多い日本のバイオベンチャーの中でも、社長が臨床開発をコアスキルとして身に付け、強力な武器としているのは同社荒井社長以外には見当たらない。
荒井社長率いる実務経験豊富な臨床開発スタッフは同社の強力な差別化要因、競争優位性である。
➂開発成功確率の高さ
2017年に導入した「PledOx® (SP-04)」に先立ち、「Sancuso® (SP-01)」、「ダリナパルシン (SP-02)」、「エピシル® (SP-03)」という3つの開発品を導入しているが、開発中止や失敗実績はなく、3つの開発品全てが事業化又は事業化に至る最終段階(「Sancuso® (SP-01)」は中国で販売開始、「ダリナパルシン (SP-02)」は最終臨床試験実施中、「エピシル® (SP-03)」は日本及び中国で販売開始)にある。
この高い開発成功確率を可能にしているのは2つの要因である。
1つ目は、失敗のリスクの低いものを選定し導入するビジネスモデル。
2つ目は、臨床開発のすべてを担うことのできるチームが社内にあること。前述のように、承認を取るためには何が必要かを熟知した開発陣は、導入品が承認をとれるか否かについてのスクリーニングをかけることができる。
1つ目、2つ目を合わせた、いわば「目利き力」が、開発断念に至るリスクを引き下げ、3打数3安打という高打率の源泉となっている。
新薬のキャッシュインフローをDCF(ディスカウント・キャッシュフロー)モデルから分析してみると、将来にわたるトータルのキャッシュインフローの大部分を構成するのは契約金やマイルストンではなくロイヤルティであるが、言うまでもなくロイヤリティは最終的に開発が成功し、販売が拡大しないと獲得することはできない。
Pled社への提案に際し、多くの競合に比べ、契約金を始めとした金額面では決して有利ではなかったにもかかわらず「PledOx® (SP-04)」を導入できたのも、明確な臨床開発設計を構築できるチーム力、先行3製品の開発実績、日本・中国を含めたアジアでの実績などをPled社が評価し、ソレイジア・ファーマがアジアにおける「PledOx®」成功のためのベストパートナーと判断したものであろう。
➃安定した事業基盤
前述のように開発品3つ全てにおいて、製薬企業への販売権導出を達成しており、自社販売と組み合わせたリスクヘッジのためのポートフォリオを構築済である。また2019年12月には、4つ目の開発品の販売権も導出し、4つ全てにおいて導出を達成している。
➄高利益確保のための自販体制
製薬会社が高い収益性を実現できているのは、自社で製造・販売双方を手掛けているためだ。
同社は現在のところ製造設備は保有していないが、収益性を高めるためにマーケットが大きくかつ効率的に営業活動が展開できる中国の三大都市(北京、上海、広州)に自社販売体制を整備している。
➅事業の早期実現
バイオベンチャーの場合、新薬開発段階では損失を計上しているのが一般的であるため、株価や事業価値の算定において損益計算書を使用することは合理的ではなく、DCFモデルを使用することとなるが、バイオベンチャーを対象とする場合、通常のDCFで使用される「時間」を基にした割引率以外に、新薬の臨床段階ごとの成功確率が割引率として考慮される。この場合、承認をいつ得ることができるかが最大のポイントとなるが、4つの開発品のうち、「エピシル® (SP-03)」は国内及び中国販売が開始され、次いで「Sancuso® (SP-01)」も中国で販売が開始となり、同社の新薬開発に関する割引率は、他のバイオベンチャーよりも低く想定されてしかるべきであろう。
以上6点以外に中国市場での成長ポテンシャルの高さを挙げることができる。
世界のメガファーマも当然中国をはじめとしたアジア各国に拠点を設けているが、同社が開発の対象とするのは経営方針にあるように、大手製薬企業が業績重視の観点から着手しないがん領域や希少疾病領域での新規製品である。近年、医薬品市場で注目を浴びるこうした製品はバイオベンチャー発のものであるが、大手は取り扱わないため、同社は、北京・上海・広州の自社販売網を含め、世界中のバイオベンチャーにとって急成長するアジア市場へのアクセスを提供できる貴重な存在となろう。加えて、中国ビジネスに強みを持ち筆頭株主でもある伊藤忠商事と中国全土(香港、マカオを除く)における販売代理店契約を締結し、そのネットワークを活用できる点も同社の大きなアドバンテージである。
2.2019年12月期第3四半期決算概要
(1)連結業績概要
|
|
18/12期3Q |
19/12期3Q |
前年同期比 |
|
売上収益 |
110 |
291 |
+181 |
|
売上総利益 |
38 |
243 |
+205 |
|
研究開発費 |
893 |
716 |
-177 |
|
販管費 |
683 |
1,113 |
+430 |
|
営業利益 |
-1,538 |
-1,585 |
-47 |
|
税引前利益 |
-1,549 |
-1,621 |
-72 |
|
四半期利益 |
-1,533 |
-1,672 |
-139 |
*単位:百万円。四半期利益は親会社の所有者に帰属する四半期利益。
売上収益は前年同期比1億81百万円増の2億91百万円。
内訳は「Sancuso® (SP-01)」および「エピシル® (SP-03)」の製品販売、「エピシル® (SP-03)」の中国での承認取得等を契機とするマイルストンやロイヤリティ収入等。
研究開発費は、同1億77百万円減少の7億16百万円。主に「ダリナパルシン(SP-02)」の国際共同第II相臨床試験(最終試験)や2018年12月に開始した「PledOx® (SP-04)」の国際共同第III相臨床試験(最終試験)等への臨床開発投資。
販管費は、同4億30百万円増加の11億13百万円。中国販売開始に伴うセールス&マーケティングを含む体制構築費用のほか、「Sancuso® (SP-01)」および「エピシル® (SP-03)」の事業進捗により開始された無形資産償却費など。
営業損失は同47百万円拡大し、15億85百万円となった。
(2)財務状態とキャッシュ・フロー
◎主要BS
|
|
18年12月末 |
19年9月末 |
|
18年12月末 |
19年9月末 |
|
流動資産 |
4,504 |
2,412 |
流動負債 |
619 |
542 |
|
現金等 |
4,046 |
1,956 |
営業債務等 |
580 |
453 |
|
営業債権等 |
193 |
158 |
非流動負債 |
21 |
108 |
|
棚卸資産 |
122 |
116 |
負債合計 |
641 |
650 |
|
非流動資産 |
3,224 |
3,660 |
資本合計 |
7,087 |
5,422 |
|
無形資産 |
3,123 |
3,492 |
利益剰余金 |
-7,975 |
1,596 |
|
資産合計 |
7,728 |
6,073 |
負債純資産合計 |
7,728 |
6,073 |
*単位:百万円。現金等は現金及び現金同等物。営業債権等は、営業債権及びその他の債権。営業債務等は営業債務及びその他の債務。
現預金の減少などで資産合計は前期末に比べ16億55百万円減少し、60億73百万円となった。
欠損金を填補し、将来の剰余金の配当や自社株取得等の株主還元策が可能な状況に近づけ、今後の資本政策の柔軟性及び機動性の向上を図ることを目的として、資本準備金の額の減少(3,712百万円)及び剰余金の処分(繰越利益剰余金の欠損填補、11,244百万円)(資本準備金及び資本金の額の減少により増加した額を含む)を取締役会で決定し、株主総会(2019年3月開催)で承認された。自己資本比率(親会社所有者帰属持分比率)は89.3%。
◎キャッシュ・フロー
|
|
18/12期3Q |
19/12期3Q |
増減 |
|
営業CF |
-1,849 |
-1,372 |
477 |
|
投資CF |
-176 |
-680 |
-504 |
|
フリーCF |
-2,025 |
-2,052 |
-27 |
|
財務CF |
3,301 |
-20 |
-3,321 |
|
現金・現金同等物 |
4,647 |
1,956 |
-2,691 |
*単位:百万円。
前年同期にあった新株発行による収入が無くなり財務CFはマイナスに転じ、キャッシュポジションは低下したが2019年12月のマルホとのライセンス契約および資本提携により、2019年12月末までに約27億円がキャッシュイン予定。
(3)各種リリース
*2019年9月、「ダリナパルシン(SP-02)」の第II相臨床試験(最終試験)において被験者の目標症例数到達
*2019年10月、「PledOx® (SP-04)」対象拡大の方針及び権利導入契約を更新
*2019年10月、「エピシル® (SP-03)」の韓国における医療機器輸入販売承認を取得
3.2019年12月期業績予想と今後の目標
(1)連結業績予想
|
|
18/12期 |
19/12期(予) |
|
売上収益 |
318 |
500~1,700 |
|
売上原価 |
213 |
200~300 |
|
売上総利益 |
105 |
– |
|
研究開発費 |
1,463 |
1,500 |
|
販管費 |
1,061 |
1,800~1,900 |
|
営業利益 |
-2,420 |
-2,000~-3,000 |
|
税引前利益 |
-2,445 |
-2,000~-3,000 |
|
当期利益 |
-2,422 |
-2,000~-3,000 |
*単位:百万円。当期利益は親会社の所有者に帰属する当期利益。
業績予想に変更無し。SP-01、SP-03販売で売上収益拡大。先行投資を拡大させるため当期損失は拡大傾向。
業績予想に変更は無い。売上においては各製品が販売開始間もないことから市場浸透速度には不確実性があり、コストにおいては臨床試験などの開始及び終了時期には不確実性があることから、現時点で特定することは困難であるため業績予想はレンジ形式によって発表している。
(売上収益)
製品販売による収益は、2018年12月期に販売開始となった「エピシル® (SP-03)」(日本)の収益、今期販売が始まった「Sancuso® (SP-01)」(中国)及び「エピシル® (SP-03)」(中国)の収益を見込む。
但し、販売初期段階での市場浸透度は想定事業規模に対して限定的なものになると想定している。また開発品権利導出による収益として、「ダリナパルシン(SP-02)」あるいは「PledOx® (SP-04)」等の導出収益を一部、一定程度見込んでいる.
*下限予想5億円のケース
「Sancuso® (SP-01)」および「エピシル® (SP-03)」でそれぞれ半々の販売を想定している。
*上限17億円のケース
「ダリナパルシン(SP-02)」もしくは「PledOx® (SP-04)」等の導出収益の一部、5億円程度想定している。
「Sancuso® (SP-01)」、「エピシル® (SP-03)」でそれぞれ6億円の販売を想定。
国内販売の伸長は、医科歯科連携の進捗、同製品の認知度向上などがカギとなる。
(営業費用)
主として以下の項目を計上する。
*「Sancuso® (SP-01)」および「エピシル® (SP-03)」の製品販売による売上原価。
*「Sancuso® (SP-01)」および「エピシル® (SP-03)」に関する中国自販体制の運営、市販後調査を含めたマーケティング活動への投資。
*「ダリナパルシン(SP-02)」の最終試験となる第Ⅱ相臨床試験への投資および、「PledOx® (SP-04)」の最終試験となる第Ⅲ相臨床試験への投資。
*「Sancuso® (SP-01)」および「エピシル® (SP-03)」の販売開始を受け、通期において無形資産の償却費が発生する。但し、償却費は過年度の支出に対応するものであり、2019年12月期において支出は生じない。
(営業損益等)
先行投資を継続するため、各段階で20億円~30億円の損失が生じる見通し。
研究開発費を除いた営業損失は5億円~15億円の予想。
(企業としての目標)
各パイプラインの目標実現のほか、パイプライン増強のため新規開発品の導入を進めている。
また数値目標としては2020年以降早期での研究開発費を除く営業利益の黒字化達成を目標としている。
仮にパイプラインは現在の4品目のままで(セールス&マーケティングコストの増加無し)、「ダリナパルシン(SP-02)」と「PledOx® (SP-04)」のライセンスアウトが無い場合でも、「Sancuso® (SP-01)」および「エピシル® (SP-03)」の売上が順調に拡大すれば2021年にも黒字化の可能性があると会社側は考えている。
償却費を除いた損益の黒字化タイミングも重視している。
(2)トピックス
◎「PledOx® (SP-04)」の日本における独占的販売ライセンス契約を締結。資本提携も実施。
2019年12月、「PledOx® (SP-04)」の日本国内における独占的販売権をソレイジア・ファーマがマルホ株式会社(大阪府大阪市)に導出するライセンス契約を締結した。
また、今後の両社の緊密な関係維持を図る観点から、マルホがソレイジア・ファーマ株式を引受ける資本提携(第三者割当増資)も実施することとなった。今後の事業展開においてマルホとの連携を図ることは、筆頭株主である伊藤忠商事株式会社等との連携に加えて、更に患者QOL向上へ寄与する可能性を拡大できると考えている。
(マルホ社概要)
1915年創業。医療用医薬品等の研究・開発・製造・販売を行う製薬企業。2018年9月期の売上高は852億円、経常利益は102億円。「Excellence in Dermatology」を長期ビジョンとして掲げ、皮膚科学領域での卓越した貢献を目指している。
(ライセンス契約の概要)
ソレイジア・ファーマが「PledOx® (SP-04)」の開発を完了した後に、マルホが日本国内において独占的に「PledOx® (SP-04)」の販売を行う。
主な経済条件は以下のとおり。
*マルホはソレイジア・ファーマに契約一時金10億円を支払う。
*マルホはソレイジア・ファーマに今後の開発及び販売の進捗に応じたマイルストン最大総額約180億円を支払う。
*ソレイジア・ファーマはマルホに対して「PledOx® (SP-04)」を独占的に販売する。
ソレイジア・ファーマでは、自社の中長期的な企業価値及び株主価値の向上に資するものと考えているが、2019年12月期の業績予想に与える影響は現在精査中。予想の修正が必要となる場合は、速やかに公表するとしている。
(資本提携の概要)
*条件
マルホは以下の条件でソレイジア・ファーマの新株を引受ける。
|
発行新株式数 |
普通株式 11,324,000株 |
|
発行価額 |
151円/株、約17億円 |
|
資金調達額 |
約16.9億円(差引手取概算額) |
|
払込期日 |
2019年12月26日 |
第三者割当増資後、マルホは伊藤忠商事(持株比率19.57%)に次ぐ第2位株主(持株比率9.70%)となる。
ソレイジア・ファーマでは、マルホが取得する株式を中長期的に保有する方針であることを口頭で確認している。
また、現在実施中の「PledOx® (SP-04)」の2つの第III相臨床試験の終了後に行われる、最初の臨床試験結果等の公表日の翌日より前に、マルホが今回の第三者割当増資により取得する株式を売却又は譲渡する場合、ソレイジア・ファーマによる事前の書面による承諾を得るものとする旨を合意している。
加えて、マルホが払込期日から2年以内に第三者割当増資により発行される株式の全部又は一部を譲渡した場合には、その内容をソレイジア・ファーマに対して書面により報告すること、ソレイジア・ファーマがその報告内容を東京証券取引所に報告すること、及びその該報告内容が公衆の縦覧に供されることに同意することにつき、マルホから確約書を取得する予定である。
*資金調達の目的
現在まで4つの製品を開発してきたが、今回調達する資金は、主に2020年6月までを目途として導入及び開発開始を予定する新規開発品「SP- 05」等への投資に充当する。
開発が完了した「SP-01」と「SP-03」の事業収入と手元流動性資金(2019年9月30日現在の現金及び現金同等物残高19億円、銀行当座貸越及び銀行コミットメントライン未使用残高35億円)により、新たな資金調達を行わなくとも一定程度の成長を伴った事業運営を図ることは充分に可能と考えている。
ただ、ミッションの実現および更なる企業価値向上のためには新規開発品の導入とその開発進行は必須と判断し、そのための長期安定的な財源を確保するため、今回の第三者割当増資の実施を決定した。
*具体的な使途
調達する資金の具体的な使途及び支出予定時期は、以下のとおり。
|
使途 |
金額 |
支出予定時期 |
|
①新規開発品SP-05の導入費用 |
1~5億円 |
2019年12月~2020年6月 |
|
②新規開発品SP-05の開発費用 |
11~15億円 |
2020年1月~2022年12月 |
①新規開発品SP-05の導入費用
現在、2020年6月までを目途として、がん治療薬及びがんサポーティブケア等の複数の医薬候補品から新規導入対象の選定を進めており、選定完了、導入実現後は、これを開発品SP-05としてその後の開発を進めていく。
その場合、1~5億円を、SP-05の開発販売権利の導入契約一時金を内容とする導入費用として支出する予定である。
②新規開発品SP-05の開発費用
導入実現後、2020年1月から2022年12月にかけて、11~15億円を、開発品SP-05の臨床試験実施を中心とした開発投資として支出する予定。
4.今後の注目点
4つのパイプラインのうち「Sancuso® (SP-01)」、「エピシル® (SP-03)」の販売が開始され、「エピシル® (SP-03)」に関しては予定通り韓国においても医療機器輸入販売承認を取得することができた。
これに加え、マルホとの「PledOx® (SP-04)」のライセンス契約締結と資本提携は、既存4製品の事業化進展・事業収益計上に加え、新規パイプライン開発開始と、短期及び中長期両面で大きなインパクトをもたらすものである。
「開発」のみではなく「販売」も始まり真の製品開発型バイオベンチャーへと進化途上のソレイジア・ファーマの今後を引き続き注目したい。
<参考1:製品開発型バイオベンチャーの時価総額推移>
下のグラフおよび表は、日米の製品開発型バイオベンチャーの時系列時価総額推移を比較したものである。
製品開発型バイオベンチャーは、医薬品などの開発権や販売権を自ら有して事業化を図り収益を得るビジネスモデルであり、
医薬品などの製品寿命は相当に長いため、ある一定数の開発品の事業化に成功すれば経営の長期安定を見込むことが可能である。その結果、Amgenを始めとした米国の製品開発型バイオベンチャーは、上場時時価総額の300~1,000倍という驚異的な企業価値拡大を実現している。
また、日本企業「そーせいグループ(4565、マザーズ)」も米国企業には及ばないものの時価総額は上場時の4倍となっている。
4つのパイプラインのうち「Sancuso® (SP-01)」、「エピシル® (SP-03)」の販売が開始され、「開発」のみではなく「販売」も始まり真の製品開発型バイオベンチャーへと進化途上のソレイジア・ファーマの今後を注目したい。
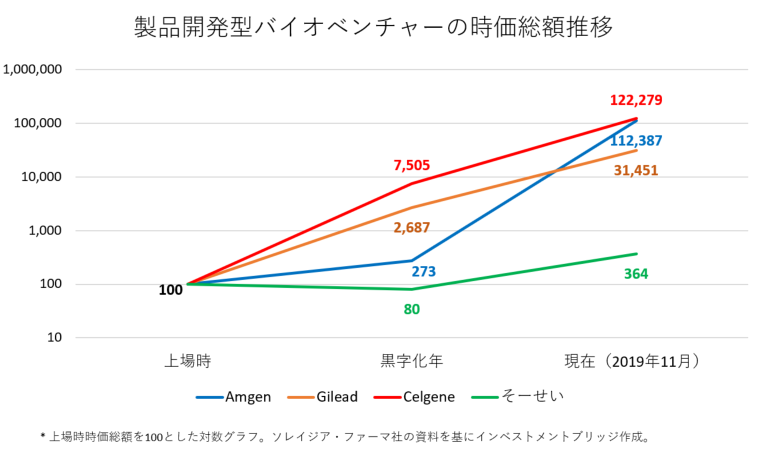
|
|
創業年 |
上場年 |
上場時 時価総額 |
黒字化年 |
黒字化年 時価総額 |
現在(19年11月) 時価総額 |
|
Amgen(米国) |
1980年 |
1983年 |
124億円 |
1986年 |
339億円 |
15兆円 |
|
Celgene(米国) |
1986年 |
1987年 |
63億円 |
2004年 |
4,728億円 |
9兆円 |
|
Gilead(米国) |
1987年 |
1992年 |
270億円 |
2002年 |
7,255億円 |
8兆円 |
|
そーせいグループ |
1990年 |
2004年 |
489億円 |
2013年 |
391億円 |
1,780億円 |
|
ソレイジア・ファーマ |
2007年 |
2017年 |
155億円 |
– |
– |
160億円 |
*同社資料より。上場年時価総額はAmgen 1984年4月、Gilead 1992年3月。1USD=108円で換算。
<参考2:コーポレートガバナンスについて>
◎組織形態、取締役、監査役の構成
|
組織形態 |
監査役会設置会社 |
|
取締役 |
6名、うち社外4名 |
|
監査役 |
4名、うち社外4名 |
◎コーポレートガバナンス報告書
最終更新日:2019年4月1日
<基本的な考え方>
当社は、医薬品開発企業としての事業活動を通じ、患者をはじめとする医療現場に貢献することが当社の使命と考えています。また、これらの事業活動を通じて、企業価値の向上と株主への利益還元を図り、ステークホルダーに対して説明責任を果たすことは、当社の使命を達成するための重要な事象であると認識しています。このため、当社は、経営の「遵法性」「透明性」を確保しつつ、社外取締役の監視・監督と監査役の監査体制を充実させることにより、コーポレートガバナンス(企業統治)を有効に機能させることを基本方針としています。
<実施しない主な原則とその理由>
「当社は、コーポレートガバナンス・コードの基本原則をすべて実施しています。」と記載している。

