サンバイオ(4592) 早期の承認取得へ期待 承認取得目標時期修正
 森 敬太 社長 |
サンバイオ株式会社(4592) |
 |
企業情報
|
市場 |
東証グロース市場 |
|
業種 |
医薬品 |
|
代表取締役社長 |
森 敬太 |
|
所在地 |
東京都中央区明石町8-1 聖路加タワー13F |
|
決算月 |
1月末日 |
|
HP |
株式情報
|
株価 |
発行済株式数(期末) |
時価総額 |
ROE(実) |
売買単位 |
|
|
708円 |
65,508,502株 |
46,380百万円 |
-195.4% |
100株 |
|
|
DPS(予) |
配当利回り(予) |
EPS(予) |
PER(予) |
BPS(実) |
PBR(実) |
|
0.00円 |
– |
-72.30円 |
– |
22.63円 |
31.3倍 |
*株価は1/11終値。発行済株式数、DPS、EPS、BPSは24年1月期第3四半期決算短信より。ROEは前期実績。
業績推移
|
決算期 |
売上高 |
営業利益 |
経常利益 |
当期純利益 |
EPS |
DPS |
|
2020年1月 |
447 |
-5,486 |
-5,146 |
-5,157 |
-100.91 |
0.00 |
|
2021年1月 |
– |
-5,801 |
-6,530 |
-3385 |
-65.38 |
0.00 |
|
2022年1月 |
– |
-6,620 |
-4,579 |
-4,677 |
-90.33 |
0.00 |
|
2023年1月 |
– |
-7,899 |
-4,698 |
-5,559 |
-95.99 |
0.00 |
|
2024年1月(予) |
– |
-4,642 |
-4,597 |
-4,598 |
-72.30 |
0.00 |
*単位:百万円、円。予想は会社側予想。当期純利益は親会社株主に帰属する当期純利益。(以下、同様)
サンバイオグループ(サンバイオ株式会社及びその米国子会社であるSanBio Inc.)の業績動向、今後の事業戦略等をお伝えします。
目次
今回のポイント
1.会社概要
2.再生細胞薬事業化の進捗
3.今後の事業目標と目指す姿
4.業績動向
5.今後の注目点
<参考:コーポレート・ガバナンスについて>
今回のポイント
- 製造における収量に関する課題(申請時点と比較して収量が減少)については、2023年12月14日付けのリリースにおいて、「収量に関する課題については解決し、審査は進捗しております。但し、審査の状況から承認取得にはもう少し時間を要するため、承認取得目標時期は2024年3月に修正いたします。承認時期は当社で決められるものではありませんが、引き続き全社一丸となり、承認取得に向け全力で取り組んでまいります」と、承認取得の目標を数か月後ろ倒すこととなった。残念ではあるが、早期の承認取得を期待したい。
- 米国子会社SanBio Inc.は23年11月末に22名の人員整理を行った。人件費削減額及び退職一時金費用の差引減少額は、1億80 百万円を見込んでいたが、概ね見込み通りの結果となった。今期の業績予想に与える影響は軽微とのこと。
- 今後、開発リソースはサンバイオ株式会社に集約していく方針だが、巨大な米国市場開拓に向けては、外部企業とのアライアンスなどを含め、引き続き、戦略を立案・実行していく考えだ。
1.会社概要
未だ有効な治療法のない慢性期外傷性脳損傷や慢性期脳梗塞など中枢神経系疾患等を治療する再生細胞薬を開発するバイオベンチャー。世界の再生医療の中心地である日本とアメリカに拠点を構え世界的な事業展開を図る。確立された量産化技術、競争優位性を高める特許戦略なども大きな強み。適応疾患と地域の拡大という掛け算による成長を目指す。
【1-1 上場までの沿革】
麒麟麦酒株式会社(現 キリンホールディングス)で研究開発を行っていた森 敬太氏(サンバイオ株式会社 代表取締役社長)は、自ら新しい事業に挑戦したいと考えていたところ、旧知の友人で、大手コンサルティング会社ボストンコンサルティング・グループのコンサルタントを経て、製薬企業向け営業支援を行う(株)ケアネット(2150、東証マザーズ)の創業に携り同社副社長であった川西 徹氏(サンバイオ株式会社 代表取締役会長)と、起業に関して意気投合した。
将来の方向性など様々な議論を行うなか、2人とも大学時代に農学部でバイオテクノロジーを専攻していたこともあり、「バイオの世界で、新しい分野、新しい市場を創り出す」ことに目標を定めた。具体的な分野として将来性の大きい「再生細胞薬」に注目し、その製品化・事業化を目指して、2001年2月、SanBio Inc.を米国カリフォルニア州に設立した。
創業にあたり、慶應義塾大学 岡野栄之(ひでゆき)教授(脳神経領域の再生医療、iPS研究で世界の第一人者。現在、慶應義塾大学大学院医学研究科委員長、日本再生医療学会理事ほか)の研究分野に着目し、協力を願い出たところ快諾を得て、同氏の紹介もあり、2002年12月、神奈川県内の国公私立大学の研究成果を企業に橋渡しする技術移転機関「よこはまティーエルオー株式会社」から、現在の開発品の基本技術となっている基本シーズに係る知的財産の譲渡を受けた。岡野氏は創業科学者としてサンバイオの創業以来、科学的な見地からのアドバイスを提供している。一方、米国では、再生医療分野での強力なネットワークを通じて、各分野の有力なアドバイザーや、優秀な研究員を獲得し、再生細胞薬の開発、製造及び大量生産技術の確立を進めてきた。
サンバイオは、同社の開発する再生細胞薬の開発・販売について、大手製薬会社との提携を模索していたが、2009年12月に再生細胞薬「SB623」の日本における脳梗塞用途の開発専用実施権許諾契約を帝人株式会社と締結。翌2010年5月には脳梗塞について、米国食品医薬品局(Food and Drug Administration以下、FDA)から臨床試験開始の承認を取得した。一方、2010年9月には大日本住友製薬株式会社と米国及びカナダにおける脳梗塞用途のオプション契約を締結。
2011年1月には米国において「SB623」の慢性期の脳梗塞を対象とした臨床試験(フェーズ1/2a)を開始し、2013年8月には被験者18名に「SB623」の投与を完了し、SB623の安全性と統計学的に有意な有効性データが確認された。
2012年12月に京都大学の山中伸弥教授がiPS細胞の開発でノーベル賞を受賞したことに加え、2014年11月に改正薬事法及び再生医療新法が施行され、再生医療等製品について早期承認制度がスタートしたのを契機に、再生医療分野での日本の存在価値が世界的に急速にクローズアップされるなか、これを絶好の機会と捉え、日本を経営の中心に米国を研究開発の拠点に世界的な事業展開を図るべく、2013年2月、日本にサンバイオ株式会社を設立。2014年1月には、サンバイオ株式会社を親会社、米国のSanBio Inc.を完全子会社とする企業再編を行い、2015年4月東証マザーズ市場に上場を果たし、日本におけるバイオベンチャーIPOとしては最大規模の73億円を調達した。
なお、23年7月に、グループの経営及び組織の効率化を図る一環として、米国SanBio, Inc.の研究・開発及び製造部門と関連する間接部門の大部分の機能を、一旦、サンバイオ株式会社に移管し、国内SB623慢性期外傷性脳損傷プログラムの承認取得及び上市のために、当面の経営資源を集中すると発表した。これに伴い23年11月までに、SanBio, Inc.における人員削減を完了する予定である。
【1-2】
サンバイオグループと開発体制
同社グループは、サンバイオ株式会社とその連結子会社SanBio Inc.(米国カリフォルニア州)の2社から構成されている。
再生細胞薬の研究開発については、2001年の創業以来、米国SanBio Inc.が中心になって手掛けてきたが、今後は日本に開発リソースを集約し、世界を見据えた事業展開を行っていく考えだ。
2022年8月には平田晋也氏が執行役員 研究開発本部長に就任した。
|
役職・氏名 |
経歴など |
| 執行役員 研究開発本部長
平田晋也氏 |
科研製薬株式会社などで、研究者として創薬・薬理研究に従事した後、メディカルサイエンスリエゾンに転身。大塚製薬株式会社、武田薬品工業株式会社、セルジーン株式会社にて、眼科や免疫・炎症性疾患等の領域で、メディカルチームの統括やKOLマネジメント、医師主導臨床研究のマネジメントなど、メディカルアフェアーズ領域に関する幅広い知識と現場経験を有す。 |
創業科学者の岡野栄之氏は脳神経領域の再生医療及びiPS細胞研究における世界の第一人者で、従来の「脳は再生しない」という常識を覆した。同社に対しては、創業時から科学的見地からのアドバイスを提供している。
米国においては、FDA元長官、スタンフォード大学元学長、米国国立衛生研究所(NIH)老化研究所元所長らをアドバイザーに迎え、開発に必要なアドバイスを受けている。
また、スタンフォード大学、ピッツバーグ大学、ニューヨーク大学、カリフォルニア大学ロサンゼルス校(UCLA)、ノースウェスタン大学などの先端医療を進める研究機関とも連携し、再生医療という先端分野に必要な強力なネットワークを構築している。
シニア・アドバイザーのダミアン・ベイツ医師は、世界で初めて「他家」細胞医薬品のFDA承認取得を成功させた人物。(「他家」「自家」については、【1-5 事業内容とビジネスモデル】にて後述)
2019年5月にダミアン・ベイツ医師の後を継いでチーフ・メディカル・オフィサーに就任したビジャン・ネジャドニク医師は腫瘍性治療薬において複数製品の生物製剤承認申請を行い、アメリカ食品医薬品局及び欧州医薬品庁より医薬品の承認を取得するなど、生物製剤や遺伝子組み換え製剤の開発に豊富な経験を有しており、同社グループの開発体制は更に強化された。
【1-3 ミッション・ビジョン】
再生医療の開発を通して、患者をはじめとしたステークホルダーへ価値を提供することをミッションとしている。
「世界をリードする最先端の科学と技術」と「臨床試験での実績」をベースに、「グローバル市場での収益拡大」を実現し、再生医療分野でのグローバルリーダーを目指すことをビジョンとして掲げている。
【1-4】
同社を理解する上でのポイント
同社の事業内容を理解するには、細胞、脳の再生、再生医療など知っておくべきポイントがいくつかある。
<細胞>
ヒトの体は37兆個以上、200種類以上の細胞で構成されていると言われている。
ヒトは、もともとは1つの受精卵から始まり、分裂、増殖を繰り返しながら、神経細胞、心筋細胞、肝細胞など、成体を構成する様々な細胞に分化(変化)していく。
ヒトの体の中には、このように最終的に分化した細胞と分化途上の細胞が存在しており、前者を体細胞、後者を体性幹細胞と言う。
体性幹細胞としては、造血幹細胞、神経幹細胞、間葉系幹細胞などがあり、これらは、限定された範囲内で各種の細胞に分化する。例えば、造血幹細胞は、骨髄に多く存在することが知られており、白血球や血小板など全ての血液系細胞を作り出しているが、通常、他の異なる細胞種には分化しない。
<脳の再生>
胎生期(受精から約9か月)においては、ヒトの脳には神経細胞の元となる神経幹細胞が存在し、それが活発に分裂・分化することで、新たな神経細胞が活発に生み出されている。しかし、この分裂能力は成体(成人の体)では消失し、大人の脳では新たな神経細胞は生み出されないと考えられてきた。
しかし、近年の研究で、成体の脳にも神経幹細胞は存在し、新たに神経細胞やその他の細胞を作る能力があることがわかってきた。
これを発見したのが同社創業科学者の岡野栄之氏である。
<ES細胞・iPS細胞 対 間葉系幹細胞(MSC)>
ES細胞(胚性幹細胞:Embryonic stem cell)は、幹細胞に比べると、より多くの種類の細胞に分化する能力があり、理論上は、心筋、神経、肝臓、血液など体内の全ての種類の細胞に分化することが可能。
体性幹細胞は限られた範囲内でしか分化できないのに対し、ES細胞では分化できる範囲が格段に広いのが大きな特徴である。
ES細胞は、不妊治療の過程で不要になった余剰胚から作製するケースが多いようだが、受精卵を使用することに関して各国で様々な倫理的議論がなされている。中絶胎児由来の細胞を使用する場合、倫理面で問題視する声も少なくない。
2007年に、京都大学の山中伸弥教授が発明した受精卵を使用しない新たな万能細胞が、「iPS細胞(人工多能性幹細胞、induced pluripotent stem cell)」である。ヒトの皮膚細胞からiPS細胞を作製することに成功している。
iPS細胞は心筋、神経、肝臓、血液など様々な細胞に分化するという点でES細胞とほぼ同等の性質を持っているが、ES細胞のような倫理上の問題は無い反面、無制限に増殖するためがん化リスクが指摘されている。
一方、健常人の骨髄液から採取される間葉系幹細胞(MSC)は、古くから骨髄移植に使用されており、倫理面での問題はなく、他の細胞に分化する能力を持つ一方、ガン化の報告もない。サンバイオが開発を手掛ける間葉系幹細胞由来のSB623は、体内に移植されると1か月以内に消失する。(サンバイオの例では)非臨床試験で成長因子を出す等して、神経細胞の回復を促す。
(細胞の種類と特長)
|
細胞の種類 |
分化能 |
増殖性 |
再生医療におけるリスク・課題 |
| 体細胞 | 分化しない | 増殖は限定的 | 無し |
| 体性幹細胞
(造血幹細胞、神経幹細胞、間葉系幹細胞など) |
限定的な細胞種に分化可能 | 増殖は限定的 | 無し |
| ES細胞
(胚性幹細胞) |
あらゆる細胞に分化可能
(多分化能) |
高い増殖能 | 倫理上の課題(不妊治療の過程で不要になった余剰胚から作製。中絶を伴う胎児由来細胞の使用)、ガン化 |
| iPS細胞
(人工多能性幹細胞) |
あらゆる細胞に分化可能
(多分化能) |
高い増殖能 | ガン化 |
<再生医療>
①再生医療とは
再生医療とは、「損傷を受けた生体の機能を、細胞や、細胞外マトリクスや成長因子などを用いて復元または活性化させる医療」。
具体的には、患者に患者本人若しくはドナーの幹細胞を移植し、目的の細胞に分化したり、既存の細胞に作用したりすることで疾患を治療するもので、アンメットメディカルニーズの高い疾患に対する根本的な治療を可能にするため、高齢化、技術革新、規制緩和といった環境の変化を受け、再生医療市場の顕在化が進むと言われている。
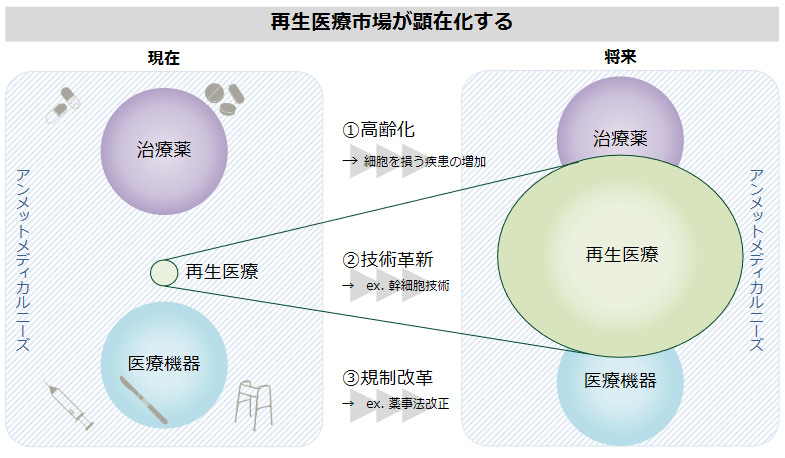
(同社資料より)
②世界が注目する日本の事業環境
経済産業省の資料によると、2012年に国内90億円、海外1,000億円だったと推計される再生医療市場は、2050年にそれぞれ2.5兆円、38兆円規模に拡大する見込み。
2006年、2007年に山中教授がiPS細胞に関する画期的な成果を上げる一方で、米国では2009年3月にオバマ大統領が、ブッシュ政権が禁じていたES細胞への連邦政府助成を解禁する法案に署名するなど再生医療における研究競争が激化する中、日本では「激化する研究競争を勝ち抜き、患者のための臨床技術とするためには、産学官が一体となった強力な体制が必要不可欠」(「再生・細胞医療の現状及び課題 2012年9月26日 厚生労働省 医政局研究開発振興課」より)との認識が強まり、「再生医療」は日本再興戦略の重要テーマの一つとして掲げられることとなった。
そうした動きに応じて、2014年11月25日には医薬品医療機器等法(薬事法が改正・名称変更された。以下、改正薬事法とも使用)や再生医療等安全性確保法が施行され、再生医療の承認に向けた法体系が確立された。特に、改正薬事法においては、有効性が推定され、安全性が確認されれば、条件及び期限付きで特別に早期に承認が得られる仕組みが導入され、販売までの期間が大幅に短縮されることとなった。
また、再生医療等安全性確保法においては細胞培養加工の外部委託が認められたことも極めて画期的で、多くの海外企業がアライアンス等を通じて日本での事業開始を表明するなど、日本の再生医療を取り巻く環境は世界が注目するところとなっている。
<早期承認(条件及び期限付承認)制度概要>
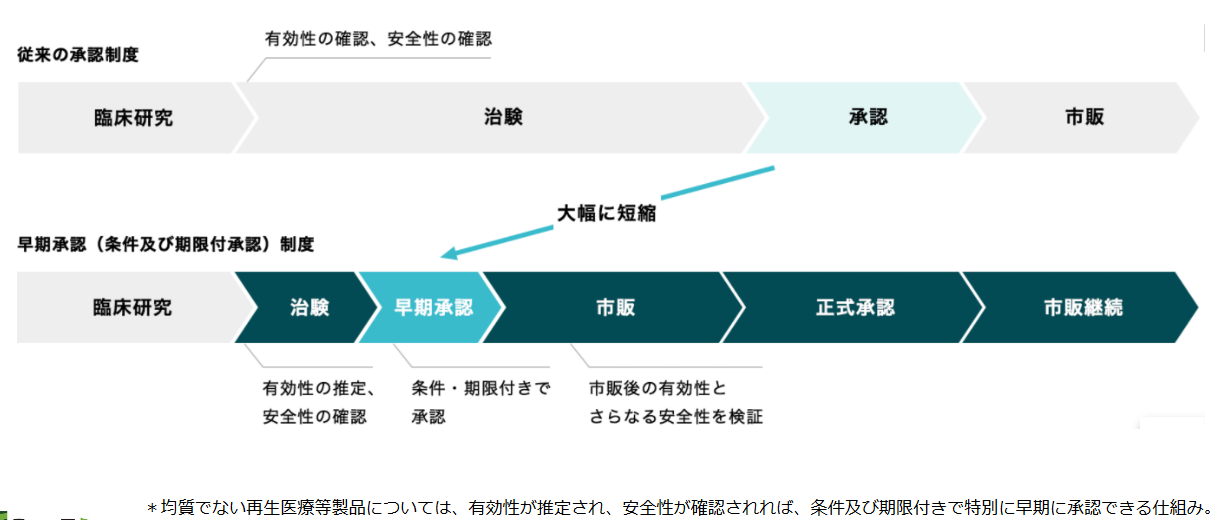
(同社資料より)
改正薬事法の下、2015年9月18日にテルモ(4533、東証1部)の重症心不全の病態改善のための骨格筋芽細胞シート及びJCRファーマ(4542、東証1部)の造血幹細胞移植後に発症する重篤な合併症に対する治療製品が製造販売の承認を受けた。どちらも申請から承認まで1年程度という短期間であった。
【1-5 事業内容とビジネスモデル】
主に慢性期(※1)脳梗塞、外傷性脳損傷、脳出血、加齢黄斑変性、網膜色素変性、パーキンソン病、脊髄損傷、アルツハイマー病等のアンメットメディカルニーズ(※2)の高い疾患を対象とした再生細胞薬の開発、製造、販売を手掛けている。
※1慢性期:同社では、発症もしくは受傷後6か月あるいは6か月以上が経過したものを慢性期と定義している。
※2アンメットメディカルニーズ:未だ有効な治療法がない治療ニーズ。

(同社資料より)
(1)再生細胞薬
①再生細胞薬とは
同社グループは上記疾患を対象とした再生医療において、「再生細胞薬」の投与による治療を目指している。
サンバイオが開発を進める再生細胞薬は、患者自身の細胞の再生機能を高め、病気・事故等で失われた身体機能の自然な再生プロセスを誘引ないし促進させ、運動機能、感覚機能、認知機能を回復させる効能が期待される医薬品である。
②他家移植 対 自家移植
再生医療に使用される細胞としては、「自家(じか)移植」と「他家(たか)移植」の2種類がある。
「自家移植」は患者本人から細胞を採取して加工・培養し、元の患者に移植し、治療するもの。これには、移植細胞の生着と栄養分を送るための血液供給機構が必要となる。さらに必要に応じて調製、加工、培養される。
「自家移植」による再生医療としては、前述のテルモの骨格筋芽細胞シートがこれにあたる。
患者の大腿部より筋肉組織を採取。組織内に含まれる骨格筋芽細胞を培養してシート状にし、そのシートを元の患者の心臓表面に移植することにより、重症心不全の病態改善が期待できるというもので、培養する細胞は患者自身から採取する自家細胞のため、理論的には免疫拒絶反応がないことが特徴として挙げられる。しかしながら、自家培養であっても、培養に使用される材料によっては免疫反応が起こる場合もあるという。自家移植は一般的に、「細胞調製に時間と手間がかかる」、「個人間のばらつきが大きい」などの点が指摘される。
他方、「他家移植」の場合は、健康なドナーから採取した細胞を加工・培養して量産化する。一人のドナーから多くの治療薬を製造することが可能であるため、自家移植に比べて、より低コストで治療でき、収益性も高いことが期待されている。
「他家移植」は、安全性および免疫適合性の問題をクリアできれば、多くの疾患に対する再生医療としてより良い選択肢となる。
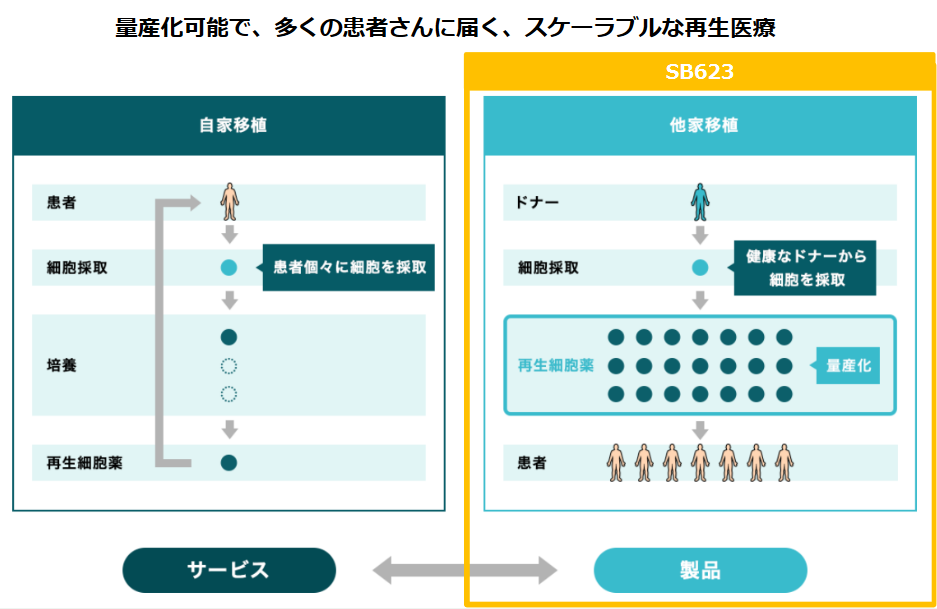
(同社資料より)
同社は「他家移植」の再生細胞薬を量産化し、「薬」として供給することを想定している。
「他家移植」採用により、従来の医薬品と同様に、「医薬品」として大量に生産し、既存の物流に乗せて世界中に届けることが可能である。
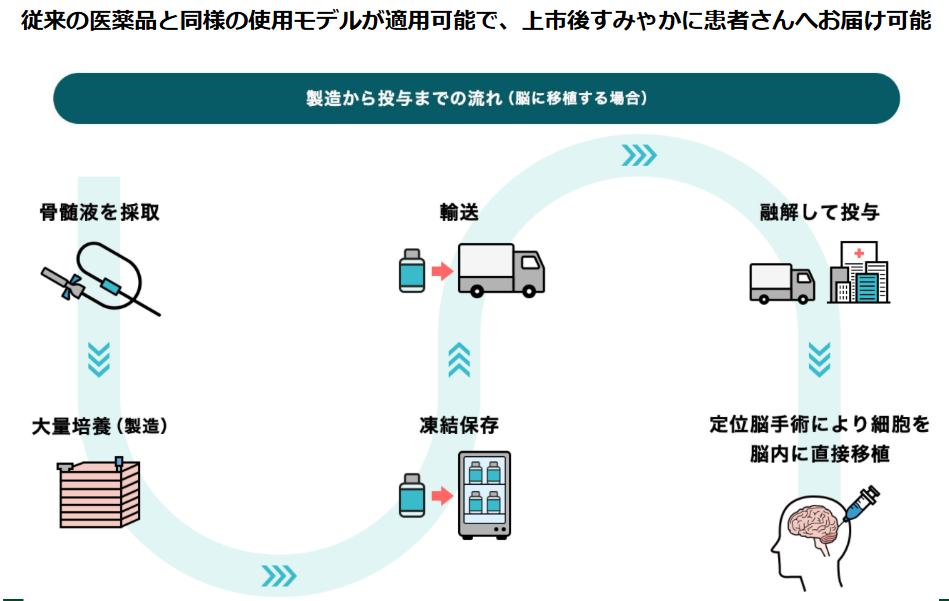
(同社資料より)
(2)再生細胞薬のラインアップ
現在は、「SB623」の慢性期の外傷性脳損傷を対象とした開発が最も進んでいる。当面は、「SB623」の適応疾患拡大に注力する模様だが、将来的には、「SB623」のほか、「SB618」、「SB308」、「MSC1」、「MSC2」といった異なる機能を持った細胞薬の開発にも取り組み、パイプラインの強化を進めている。
|
再生細胞薬コード |
種類 |
適応疾患 |
| SB623 | 神経再生細胞 | 慢性期脳梗塞、外傷性脳損傷、脳出血、加齢黄斑変性、網膜色素変性、パーキンソン病、脊髄損傷、アルツハイマー病等 |
| SB618 | 機能強化型間葉系幹細胞 | 末梢神経障害等 |
| SB308 | 筋肉幹細胞 | 筋ジストロフィー等 |
| MSC1 | 間葉系幹細胞 | がん疾患 |
| MSC2 | 間葉系幹細胞 | 炎症性疾患 |
パイプライン拡大に向けては、日本医科大学、順天堂大学、旭川医科大学などとの共同研究を進めており、今後もアカデミアとのアライアンスを推進していく。
(3)再生細胞薬「SB623」
①「SB623」の効能
「SB623」は神経機能を再生する作用を持つ可能性を持つ治療薬で、体の自然な再生プロセスを促進させ、病気やケガで失われた運動機能、感覚機能及び認知機能の再生を目標としている。具体的な発現作用としては、①神経細胞をまもる、②神経細胞をつくる、③血管をつくる、④炎症を抑える等があり、これまでの研究によると、これらが複合的に作用することが示唆されている。
②「SB623」の対象領域
再生医療に取り組んでいる他社が主に急性期を対象としているのに対し、同社では「SB623」の対象領域を、既存の治療方法では予防・改善効果が限定的でアンメットメディカルニーズが高い慢性期と設定している。

(同社資料より)
③「SB623」の投与方法
投与方法は、慢性期の外傷性脳損傷及び脳梗塞の場合、定位脳手術と呼ばれる既に脳神経外科では広く普及した手技により、局所麻酔で安全に投与される。
(同社資料より)
長期入院も不要で、米国における臨床試験では被験者は一日入院し、投与翌日には退院している。投与に当たっては免疫抑制剤も不要で、通常の医薬品と同様に、同一の製品を全ての患者を対象に使用することが可能である点も大きな特徴だ。
(3)ビジネスモデル
①概要
自社開発・自社販売のケース、パートナーとなる製薬企業との事業提携によって開発および製造・販売を行うケースの2つを見込んでいる。
事業提携のケースでは、パートナー製薬会社に開発権及び販売権をライセンス許諾する。契約に応じて、①契約一時金収入、②開発マイルストン収入、③開発協力金収入、④ロイヤルティ収入、⑤製品供給収入、⑥販売マイルストン収入等を得るビジネスモデルとなっている。④ロイヤルティ収入、⑤製品供給収入、⑥販売マイルストン収入は製品売上の一定割合として支払われるため製品売上に比例して増加することとなる。
技術導入、研究開発・試験、製品製造については、委託先である大学等研究機関、研究受託機関、製造受託機関等に対し適宜委託費用を支払う。
国内慢性期外傷性脳損傷プログラムについては、自社販売を目指している。その他のプログラムについては、状況に応じて、自社販売又は製薬企業との事業提携の選択を検討する。
|
収入形態 |
内容 |
| ①契約一時金収入 | ライセンス許諾の契約時の一時金として得られる収入。 |
| ②マイルストン収入 | 開発進捗に応じて設定したいくつかのマイルストンを達成するごとに一時金として得られる収入。上市後は予め設定した売上マイルストンの達成ごとに一時金として得られる収入。 |
| ③開発協力金収入 | 開発費用のうち、ライセンスアウト先負担分として得られる収入。 |
| ④ロイヤルティ収入 | 製品売上のうち、ロイヤルティとして一定割合を得られる収入。 |
| ⑤製品供給収入 | 製品供給の対価として得られる収入。 |
*上記は、提携先であった大日本住友製薬株式会社との間の契約を例に、いくつかの収入形態をまとめたもの。
➁事業提携状況
現時点では開発・製造・販売に関して事業提携しているパートナー製薬会社は無い。自社での開発や新たなパートナーとの提携など、複数の選択肢の中から、最速で患者に治療薬を提供できる方策を検討している。
日本における脳梗塞プログラムについては帝人から権利の返還を受け、同社単独で開発を進めている
【1-6 特徴と強み】
(1)巨大なターゲットマーケット
疾患別に見ると、同社が注力する中枢神経系及び眼科領域はがんに次いで大きく市場拡大することが予測されている。また、作用機序別でも、同社が開発を進める細胞移植治療は、大きな市場拡大が予測される。
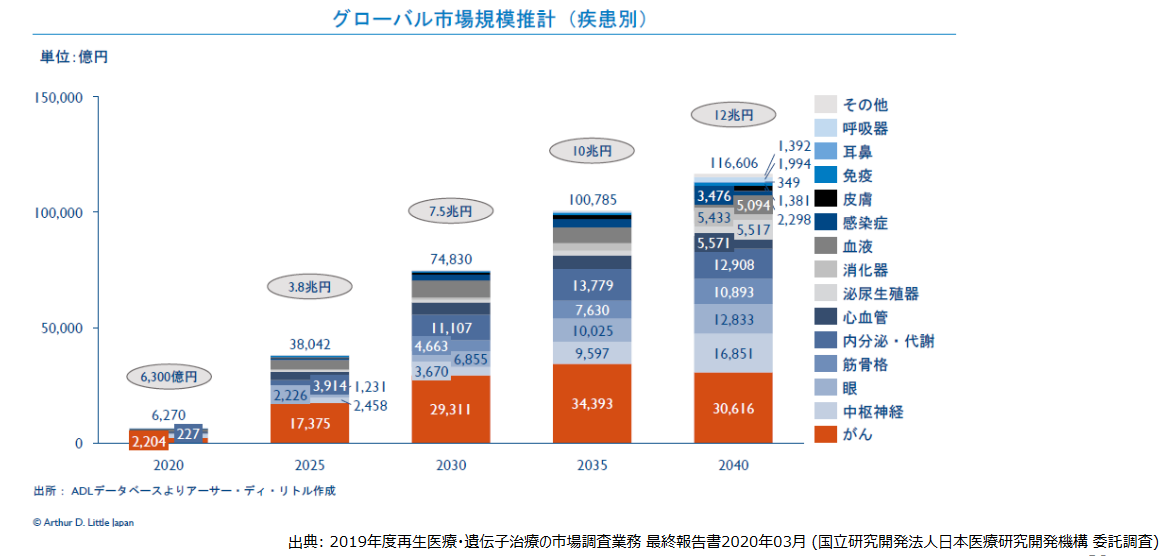 |
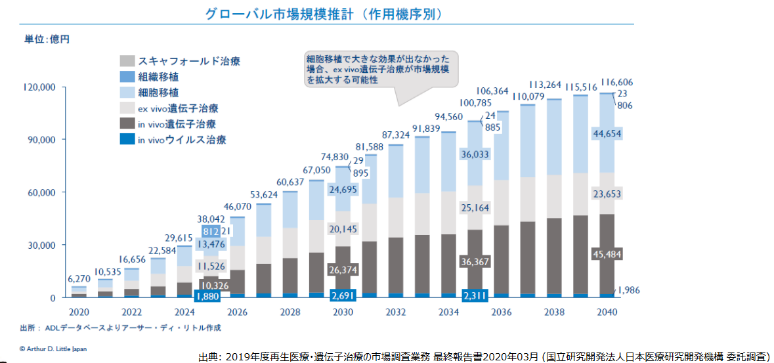 |
また、同社の再生細胞薬の対象となる疾患は、世界的に旧来の医療では対応できなかった中枢神経系領域が中心であるため、対象患者数が多いことが見込まれる。
同社の調べによれば、脳梗塞患者数は日・米・欧・中国・豪合計で約2,600万人。外傷性脳損傷で同約2,300万人。
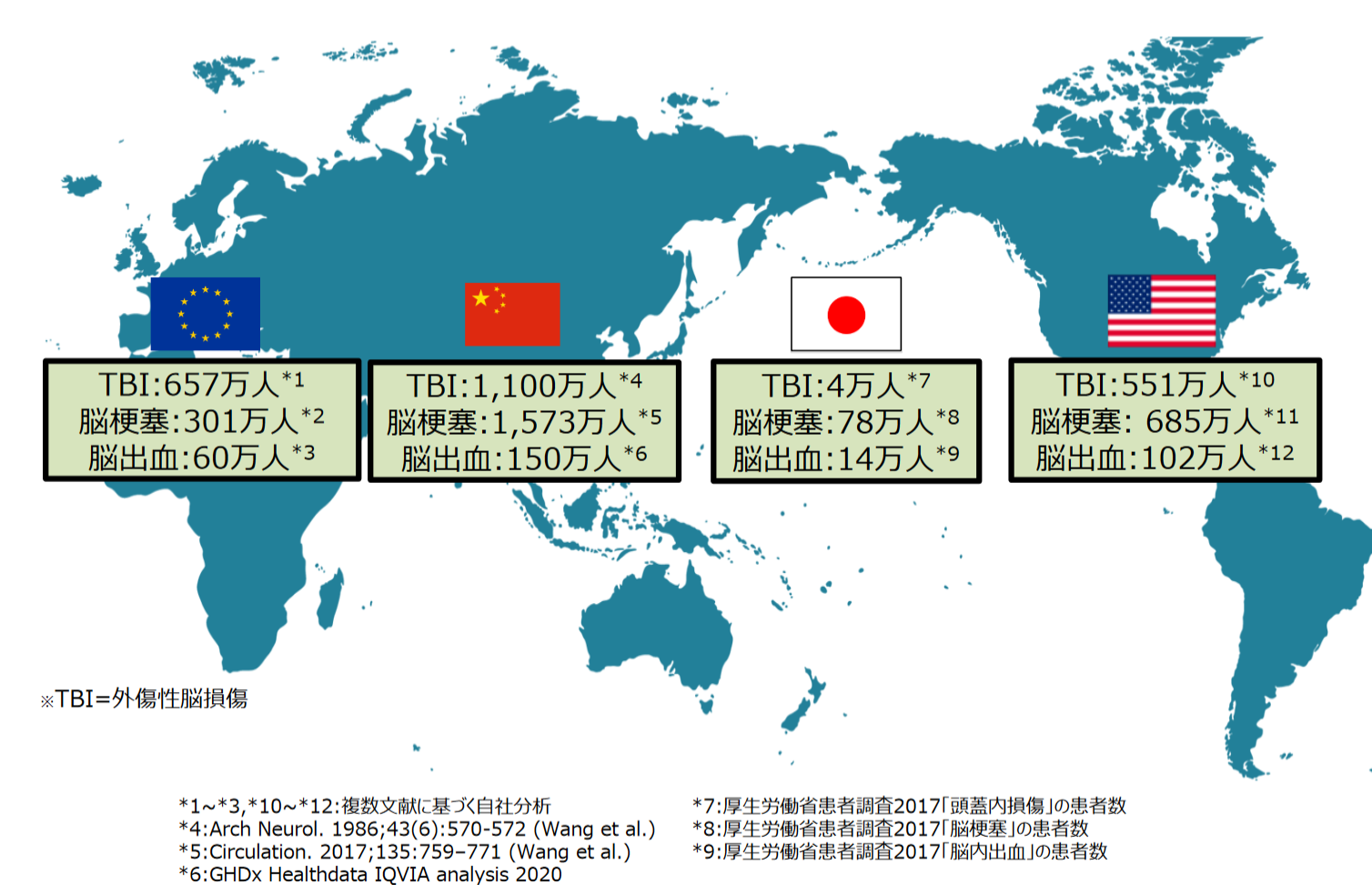
(同社資料より)
この他、アルツハイマー病、パーキンソン病、加齢黄斑変性、網膜色素変性等、既存の医療・医薬品では対処できない多くの神経系疾患に対する再生細胞薬の有効性が広く認められれば、同社は世界的な巨大マーケットを開拓するとともに、多大な社会貢献を果たすこととなろう。
(2)競争優位性を高める特許戦略
開発及び製品販売に伴う収入の極大化を目指すため、再生細胞薬の開発に必要な知的財産を全て自社で取得することを特許戦略の基本方針としており、開発を進めている再生細胞薬(SB623、SB618、SB308)の基本特許は全て取得済みだ。
現在、以下の様に主要市場全てで基本特許を取得済みであり、地域ごとの特性を考慮して、自社単独もしくは有力なパートナー製薬企業との契約締結も検討しつつ、世界各地における臨床試験、製造開発、製品販売に向けた基盤の整備を進めていく考えだ。
医薬品の特許には「物質特許」、「製法特許」、「製剤特許」、「用途特許」の4つがある。
このうち物質特許は物質そのものを保護する特許で、医薬品の特許のなかで最も重要で権利範囲の広い特許として取得に大きな費用と時間が必要になる。物質特許を取得できれば、開発した医薬品を独占的に製造・販売することができるため、同社グループでは「物質特許」の取得に最も力を注いでいる。
(3)製品供給権を確保
他社からライセンス導入して研究開発を行う創薬ベンチャー企業の場合、多くはパートナー製薬会社が製造を担い創薬ベンチャー自らが製品供給権を保有していないため、製品販売後の売上は製品販売に伴うロイヤルティ収入のみとなってしまう。
これに対し同社の場合、再生細胞薬は、他社からのライセンス導入品ではなく、基礎段階から自社で研究開発を行ってきた独自製品である。そのため、パートナー製薬会社との関係においては、再生細胞薬の製造を同社が担うため、製品販売後は製品販売に伴うロイヤルティ収入に加え、製品供給の対価として製品供給収入も獲得することが可能であり、収益源がより多角化している点も注目される。
(4)確立された量産化技術&再生細胞薬の安全性
再生細胞薬は、健常者ドナーの骨髄液から採取した細胞に、神経再生能力を高めるため遺伝子を導入(一過性)し、それを大量に増殖して作られている。
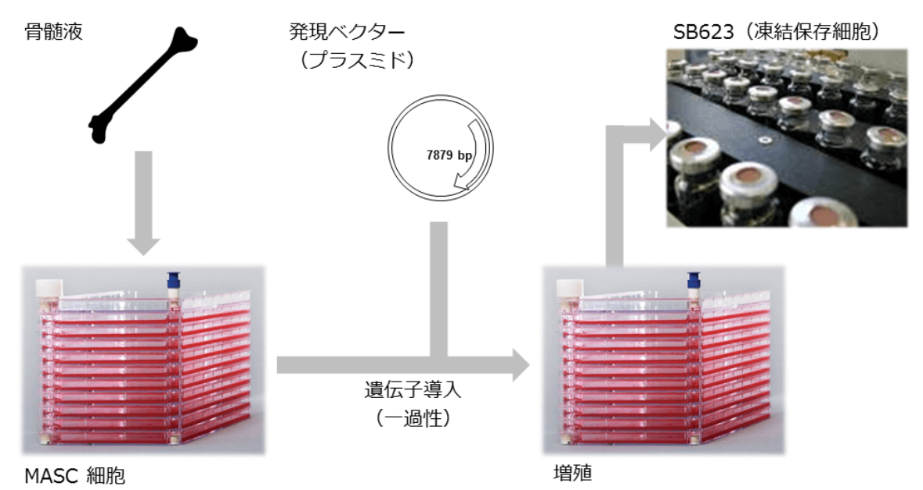
(同社HPより)
加工培養、製造、保存、輸送、投与までの技術は既に確立されており、製品販売後の量産に対応できる段階に達している点は同社の大きなアドバンテージとなっている。
また、倫理上の問題を指摘されるES細胞や、がん化リスクのあるiPS細胞に比べ安全性が高いと考えられる点からも、臨床現場から受け入れられやすいと想定できることも同社の差異化要因である。
2.再生細胞薬事業化の進捗
(1)開発
現在は、外傷性脳損傷を対象とした「SB623」の開発が最も進んでいる。2022年3月に、厚生労働省に対して、再生医療等製品製造販売承認を行った。
今後は、「SB623」の対象疾患の拡大や地域の拡大に加え、「SB618」、「SB308」、「MSC1」、「MSC2」といった異なる機能を持った細胞薬の開発にも取り組み、パイプラインの強化を進めていく。そのためにも、まずは日本における再生医療等製品製造販売承認取得が最も重要な目標である。

(同社資料より)
①外傷性脳損傷プログラム
「SB623」の疾患ターゲットとしては外傷性脳損傷用途の開発が最も進んでいる。2022年3月に、厚生労働省に対して、再生医療等製品製造販売承認申請を行った。
外傷性脳損傷は、交通事故や転倒などで頭に強い衝撃が加わり脳が傷つくことによって起こる疾患で、半身の麻痺や感覚障害、記憶障害等の他、行動や感情のコントロールが困難になる高次脳機能障害といった深刻な後遺症が残る。改善を期待できる期間は脳梗塞よりもやや長いものの損傷後半年から1年程度にとどまり、それを超えると有効な治療法が存在しないとされている。
なお、米国で救急受診する患者数は年間約250万人で、後遺障害を抱える人の数は米国だけでも530 万人に上り、毎年28万人以上の新規患者が慢性的な障害に苦しんでいるとされている。
前述のように米国以外でも、患者数は多数に上る。
外傷性脳損傷向け医薬品の臨床段階の競合品は限られている上、急性期を対象としており、慢性期を対象とする「SB623」は競争優位性が高いことは同製品の特徴の一つとなっている。
| 2015年 |
4月 |
外傷性脳損傷は、損傷部位や症状が脳梗塞に似ているほか、「SB623」の投与方法も同様であることから、「SB623」の適応疾患としてフェーズ1をスキップし、フェーズ2から治験を開始することでFDAと合意し、承認を取得。 |
| 2016年 |
7月 |
フェーズ2を「外傷性脳損傷受傷後12か月以上が経過した運動機能障害がある慢性期の患者」を対象とした日米グローバル治験として、日米約40施設で実施することとし、米国で最初の被験者の組入れを実施。 |
|
10月 |
日本で最初の被験者の組入れを実施。 | |
| 2018年 |
4月 |
予定(52名)を上回る被験者数61名(二重盲検試験)の患者組入れを完了。 |
|
11月 |
6か月の経過観察および解析期間を経て、2019年1月期中という会社側の予定通り、以下のような主要評価項目達成との解析結果を得た。
(解析結果) 日米グローバル第2相試験の主要評価項目Fugl-Meyer Motor Scaleにおいて、運動障害を伴う慢性期外傷性脳損傷患者にSB623を投与した群は、コントロール群と比較して、統計学的に有意な運動機能の改善を認め、主要評価項目を達成した。 24週時点のFugl-Meyer Motor Scaleのベースラインからの改善量は、SB623投与群で8.7点に対し、コントロール群では2.4点であった。 安全性についても、SB623のこれまでの試験の安全性プロファイルと一致しており、新たな安全性の懸念は認められなかった。 |
|
| 2019年 |
4月 |
厚生労働省より、慢性期外傷性脳損傷を対象にした「SB623」が再生医療等製品として「先駆け審査指定制度(先駆的医薬品指定制度)の対象品目の指定を受ける。 |
| 2020年 |
6月 |
「SB623」が外傷性脳損傷における後遺症の改善を効能として希少疾病用再生医療等製品に指定。 |
| 2022年 |
3月 |
外傷性脳損傷後の運動機能障害の改善を効能、効果として、厚生労働省に対して再生医療等製品製造販売承認を申請 |
先駆け審査指定制度とは、2014 年6月に厚生労働省における「世界に先駆けて革新的医薬品等の実用化を促進するための省内プロジェクトチーム」において発表された「先駆けパッケージ戦略」に基づき新たに設けられた制度で、早期の治験段階で著明な有効性が見込まれる革新的な医薬品について優先審査するというもの。世界で初めて日本が制度化した。
2019年4月の同指定により、PMDAから薬事承認に係る相談・審査の優先的な取扱いを受けることが可能となるため、同社グループはこの利点を活かして、日本で2020年1月期(2019年2月~2020年1月)中に、国内の再生医療等製品に対する条件及び期限付承認制度を活用した再生医療等製品としての製造販売の承認申請を行う計画としていた。
ただ、2019年12月に、「新体制への技術移転の遅延」「商業生産に必要な管理体制の構築」「規格試験の要件不足」という要因により、薬を待ち望んでいる患者全員に確実に薬を届けるためには、さらなる安定供給に向け、各種の管理体制構築や製造スタッフへの教育等体制強化が必要で、時間をかけて準備を進めるべきだと判断し、承認申請を延期した。
その後、これらの課題解決に取り組むとともに、先駆け審査指定制度(※)の枠組みにおいて、承認申請の前段階となる「先駆け総合評価相談」のフェーズにおいて独立行政法人医薬品医療機器総合機構(PMDA)との協議を進めた結果、2022年3月7日、厚生労働省に対して再生医療等製品製造販売承認申請を行った。
注:22年7月22日のリリース「国内SB623慢性期外傷性脳損傷プログラム製造販売承認取得の状況について」では、22年8月に開催された薬事食品衛生審議会 再生医療等製品・生物由来技術部会において「SB623」は、議題に含まれていなかったため、9月までの承認取得はないものと同社では判断していたが、その後の続報(22年10月20日リリース)では、生産関連の審査に対する同社の従前からの対応がより具体化し、まだ時間を要すことが判ったため、同社としては、「今期中の承認取得は無いものと判断している」と発表した。
今後は、審査、承認、薬価収載を経て、販売を開始する。現在、製造販売承認を見据えて国内販売体制の準備を進めている(詳細は、(2)製造・販売体制で後述)。
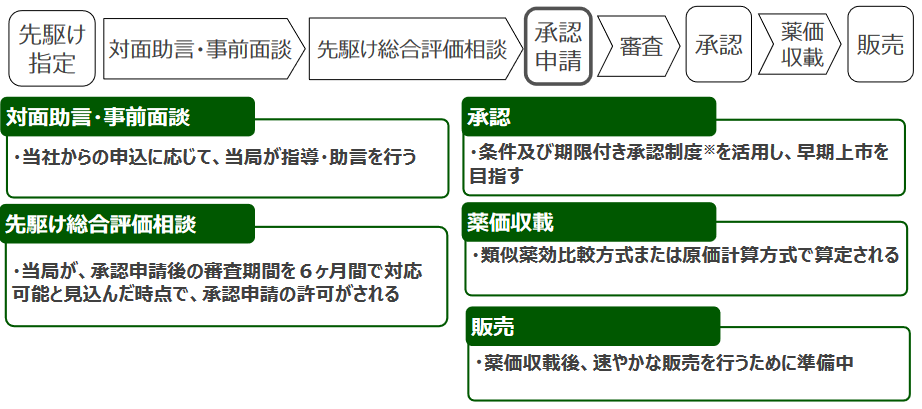
(同社資料より)
一方、研究開発に関しては以下のような進捗が注目される。
| 2019年 |
4月 |
日米グローバルフェーズ2臨床試験(STEMTRA試験)の有効性及び安全性に関する詳細結果を、米国サンディエゴで行われた米国脳神経外科学会(American Association of Neurological Surgeons:AANS)の年次総会で発表し、良好な結果を公表。
(公表内容) このSTEMTRA試験では、SB623投与群46名、コントロール群15名の合計61名の被験者で行われ、主要評価項目はFugl-Meyer Motor Scale(FMMS)のベースラインからの改善量(運動機能障害の変化を測定するFMMSにおいて、10点以上の改善は外傷性脳損傷における臨床的に意味のある改善量とされる。)とし、その結果は、24 週時点のFMMSのベースラインからの改善量が、SB623 投与群8.7 点、コントロール群2.4 点となり主要評価項目を達成した。 また、10点以上の改善は、SB623投与群18名(39.1%)、コントロール群1名(6.7%)であったことから、統計学的な有意差が認められた。さらに、新たな安全性の懸念は認められなかった。
STEMTRA試験の結果はその後も、日本(4月、8月)、米国(8月)、中国(9月)等で開催されてた学会で公表され、世界でも類を見ない臨床試験結果が高く評価されている。 |
|
4月 |
欧州医薬品庁(European Medicines Agency:EMA)が「SB623」を、先端医療医薬品(Advanced Therapy Medicinal Product:ATMP)に指定。
ATMPとは、遺伝子、組織、または細胞に基づいたヒト用の薬で指定についてはEMAの先進療法委員会によって決定される。ATMPの指定を受けた治療は、その病気や怪我の治療に対し画期的で新しい好機を提供する。 |
|
|
9月 |
米国食品医薬品局(U.S. Food and Drug Administration:FDA)が、「SB623」を「RMAT:Regenerative Medicine Advanced Therapy」の対象品目に指定。
「RMAT」は米国21st Century Cures Act(21世紀治療法)のもとに設立された制度で、RMAT指定を受けた企業は、指定品目に関する優先審査と迅速承認の機会を得る。 |
|
| 2021年 |
1月 |
STEMTRA試験中間解析結果が米国神経学会(American Academy of Neurology)の学会誌Neurology®オンライン版に掲載された。
(主要評価項目) SB623投与群と偽手術群において、6カ月後のFugl-Meyer Motor Scale(FMMS)のベースラインからの変化量に統計学的な有意差が認められた。
(副次評価項目&安全性評価) *6カ月後のDRS(Disability Rating Scale)やAction Research Arm Test (ARAT), GV (Gait Velocity), Global Rating of Perceived Change (GRPC)において、ベースラインからの改善傾向が認められた。 *SB623投与群と偽手術群において有害事象に差は認められなかった。 *SB623治療の忍容性は高く、有害事象のために離脱した患者はいなかった。
と、良好な結果であった。
この結果については、脳神経領域の世界的権威であるMashaSavelieff博士、Eva Feldman医師によりNeurology® Editorialでも取り上げられ、その他複数の媒体で紹介されるなど高く評価されている。
また、3月に開催された日本脳神経外傷学会においても発表され、脳神経外傷の日本での権威である川堀真人氏が「有効な治療法が無かった外傷性脳損傷による運動機能障害に対して、コントロール群を設定し二重盲検にて間葉系間質細胞の脳内投与の有効性を証明した報告はこれが初めてである」と報告した。 |
|
11月 |
慢性期の運動機能障害を有する外傷性脳損傷患者を対象とした評価指標の比較データを Expert Review of Neurotherapeutics 誌に発表した。
Center For Neurotrauma Research の共同責任者でありウィスコンシン医科大学脳神経外科教授でもある 本論文の筆頭著者マイケル・A・マクレー氏は、次のように述べ、高く評価している。 「慢性期における外傷性脳損傷の臨床試験の成功を定義する指標は確立していないため、外傷性脳損傷による運動機能障害を有する患者の評価に関する本論文発表は、この研究分野における大きな前進です。本研究結果は、外傷性脳損傷に起因する慢性期運動機能障害を有する患者を対象とした今後の臨床試験において、長期的な機能的転帰と運動機能障害の評価に Disability Rating Scale(DRS)および Fugl-Meyer Motor Scale(FMMS)を用いて評価することが適切であることを裏付けるものです」
また、サンバイオグループの執行役員、チーフ・メディカル・オフィサーおよび研究開発ヘッドを務めるビジャン・ネジャドニクは次のように述べている。 「サンバイオでは、外傷性脳損傷または脳卒中による慢性期の運動機能障害を有する患者さんの生活の質の向上に熱意をもって取り組んでいます。本論文は、臨床研究における最も難しい分野の一つである、慢性期運動機能障害を有する患者さんにおける臨床的に有益であると解釈できる最小の変化値の定義につながるものです。この重要な研究を支援してくださった医師やリハビリ専門家の皆様に感謝を申し上げます」 |
|
|
4月 |
慢性期の運動機能障害を有する外傷性脳損傷患者を対象に、偽手術と比較した SB623 の有効性と安全性を評価したSTEMTRA 試験の 1 年間の最終解析結果において主要評価項目を達成し、運動機能と日常生活動作に改善傾向が認められたと発表した。
(米国神経学会(American Academy of Neurology, AAN)年次総会のプレナリーセッションで発表)
|
|
| 2022年 |
4月 |
STEMTRA試験の最終解析結果が米国神経学会 2022年次総会 Clinical Trials Plenary Sessionの演題に採択され発表された。 |
|
5月 |
同じく、最終解析結果がA*STAR Advances in Cell and Gene Therapy(A*CGT) Symposiumで発表された。 | |
|
6月 |
第59回日本リハビリテーション医学会学術集会、The 39th Annual Symposium of the National Neurotrauma Societyで最終解析結果が発表された。 | |
| 2023年 |
3月 |
第14回世界脳損傷学会で、STEMTRA 試験の最終解析結果が発表された。 |
2021年1月に発表されたSTEMTRA試験の解析結果は良好で国内外で高く評価されており、今後への期待が膨らんでいる。
ただ、グローバルフェーズ3臨床試験の開始は経営資源の選択と集中の観点から自社開発又はパートナーリング等のオプションを含め、開始時期を検討中である。
同社では以上のような研究開発と並行して、外傷性脳損傷と共に生きる患者や家族を支援する制度の構築にも注力している。
2021年12月に、全米外傷性脳損傷レジストリ協会(National TBI Registry Coalition:NTRC)の発足にあたり、設立会員として参画した。
同協会は、全米の外傷性脳損と共に生きる患者や家族のレジストリ(データベース)を創設するという目的のために米国政府と連携していくことに特化した団体で、複数の非営利団体と企業組織により構成されている。
外傷性脳損傷に関する何らかのレジストリ(データベース)を行っている州は14州のみで、レジストリを実施している特定の州が独自に登録を開発・管理しており、データベースとしてはボリューム、使い勝手ともに不十分なのが現状である。
そこで、同協会では、外傷性脳損傷の発生動向の監視と予防や新たな治療法やサービスに関する情報量を拡大し、また患者や家族がそうした情報により容易にアクセスすることができる環境を構築することを目指している。
②慢性期脳梗塞プログラム
「SB623」の対象疾患の一つである脳梗塞は、脳の血管が詰まることで、その先の神経組織に栄養が届かなくなり、細胞が機能を失ったり死んでしまう病気である。脳梗塞は、発作後数時間までの急性期には血栓溶解剤も有効だが、それを過ぎるとリハビリ以外に対処方法はなく、さらに6~12か月を過ぎた慢性期に入ると多くの場合、リハビリによる改善効果も期待できないと言われる。
◎開発状況
*米国
| 2014年 |
6月 |
「SB623」のフェーズ1/2a臨床試験の結果を受けて、FDAから次のフェーズ2bの臨床試験実施承認を取得。 |
|
9月 |
大日本住友製薬株式会社が先に締結したオプション契約を行使し、米国及びカナダにおける「SB623」の脳梗塞用途の共同開発をスタート。 | |
| 2015年 |
8月 |
フェーズ1/2aの2年間の経過観察期間が終了。 |
|
9月 |
フェーズ2b へ進むに当たり、最初の治験施設との契約締結により共同開発パートナーである大日本住友製薬からマイルストン収入5百万米ドルを受領。 | |
|
12月 |
「脳梗塞発症後6か月から90か月が経過した運動機能障害がある慢性期の患者」を対象にフェーズ2b(被験者数156名、二重盲検試験)の被験者募集を開始。 | |
| 2016年 |
3月 |
最初の被験者の組入れを実施した、大日本住友製薬から5百万米ドルのマイルストンを受領。 |
| 2017年 |
6月 |
フェーズ2b試験に対しカリフォルニア州再生医療機構より、総額20百万米ドルの補助金を獲得。開発の進捗に応じて、補助金を受領し、2019年3月までに19百万米ドルを受領済。 |
|
12月 |
約3か月前倒しで予定(156名)を上回る163名の組入れを完了。経過観察および解析へ。 | |
| 2019年 |
1月 |
解析結果速報が公表。
投与6カ月後にFugl-Meyer Motor Scaleがベースラインから10ポイント以上改善した患者の割合(主要評価項目)について、SB623投与群は、コントロール群(SB623を投与せずSham手術を実施)と比較して、統計学的な有意差を示さず、安全性の問題は認められなかったものの主要評価項目を達成することができなかった。 |
|
12月 |
米国子会社SanBio Inc.と大日本住友製薬株式会社において共同開発を中止し、ライセンス契約を解消することで合意。 | |
| 2020年 |
9月 |
フェーズ2b臨床試験の追加解析結果を報告。次のSB623脳梗塞プログラムや脳出血プログラムの後期臨床試験の準備を開始。 |
2020年9月発表のフェーズ2b臨床試験の追加解析結果概要は以下の通り。
| * | 追加解析にあたり、Minimal Clinically Important Difference (MCID:患者における変化が臨床的に有益であると解釈できる最小の変化値)の観点および、外傷性脳損傷を対象としたSTEMTRAの結果を踏まえ、複合FMMSという評価方法を用いて解析を実施。 |
| * | 試験組み入れ患者(163名)のうち、梗塞巣サイズが一定量未満の患者77名(試験組み入れ患者全体の47%)を対象に、「FMMS上肢スコア(≧6ポイント)、FMMS下肢スコア(≧4ポイント)、FMMS総スコア(≧9ポイント)の3つのFMMS改善基準(ベースラインからの改善)のうち、投与後6カ月時点で少なくとも1つを達成した患者の割合」を複合FMMSエンドポイントとして評価。 |
| * | 偽手術群26名のうち19%の改善に対し、SB623投与群51名のうち49%において改善が見られ、統計学的に有意な結果を示した(P=0.02)。 |
| * | この複合FMMSのエンドポイントは、試験の主要評価項目「投与6カ月後にFMMSがベースラインから10 ポイント以上改善した患者の割合」と比較しても、治療効果の臨床的意義を説明できるとサンバイオグループでは考えている。 |
この結果を受け、同社グループは、次のSB623脳梗塞プログラムや脳出血プログラムの後期臨床試験の準備を開始した。
両プログラムの具体的な臨床試験デザインや開発内容については、確定次第速やかに公表する予定。
今後、経営資源の選択と集中によりSB623の価値早期最大化を図るため、承認申請が完了したSB623外傷性脳損傷と並行し、脳梗塞プログラムと脳出血プログラムの国内における開発を優先する。
グローバル試験については、自社開発あるいはパートナーリング等のオプションも視野に入れ、今期以降の開始を検討している。
*日本
開発権及び販売権を帝人㈱にライセンスアウトしていたが、「SB623」に対する患者の期待の声がますます強まる中、両社協議の結果、開発および上市を更にスピードアップさせるためにはサンバイオが単独で取り組むことが適当であるとの判断に至り、2018年2月付で両権利がサンバイオに返還された。
米国フェーズ2b臨床試験の追加解析結果及び慢性期外傷性脳損傷の治験結果を踏まえ、フェーズ2bまたはフェーズ3からの開始に向け、独立行政法人医薬品医療機器総合機構(PMDA)との協議を開始する予定である。
◎研究
2022年8月、CNS Neuroscience & Therapeuticsが、「Transplantation of modified human bone marrow-derived stromal cells affords therapeutic effects on cerebral ischemia in rats」と題する論文を発表した。
カプセル化したSB623細胞の移植による治療効果を急性期脳梗塞モデルラットにおいて確認した結果、mNSS評価において、SB623細胞群およびカプセル化SB623細胞群は他の群に比べ有意に改善した。組織学的評価では、SB623細胞群およびカプセル化SB623細胞群において梗塞面積の減少が認められた。カプセル化SB623細胞群では脳室下帯で高い細胞生存率および神経新生がみられ、それらは他の全群と比較して有意に増加した。
この結果、「SB623細胞はカプセル化・非カプセル化ともに脳梗塞に対する治療効果を示した。カプセル化したSB623細胞は、より強力な神経新生の促進作用及びカプセル内での高い生存率を示した。この研究は、移植されたSB623細胞による細胞間相互作用というよりSB623細胞の有する分泌機能が、SB623が脳梗塞の治療効果を発揮する上での主要なメカニズムとなっていることを明らかにした」との考察を発表し、脳梗塞に関しSB623の新たな可能性を示唆するデータを取得した。
また、2023年1月にジャーナルStem Cell Research & Therapyに掲載された論文「Synergistic therapeutic effects of intracerebral transplantation of human modified bonemarrow-derived stromal cells (SB623) and voluntary exercise with running wheel in a ratmodel of ischemic stroke」では、以下のような結果が得られたと発表した。
脳梗塞モデルラットを、SB623投与群、自発運動群(ランニングホイール)、SB623投与+自発運動群、対照群に振り分け、行動テスト(modified neurological severity score(mNSS)、シリンダー試験)、組織学的分析及びmRNA発現解析を実施したところ、SB623投与+自発運動群は、 mNSSにおいて対照群に比べ有意な神経学的回復を示し、脳梗塞面積は他の全群に比べ有意に減少し、脳室下帯(SVZ)および歯状回(DG)のBrdU/Doublecortin(Dcx)二重陽性細胞数,虚血境界域(IBZ)のlaminin陽性領域、脳由来神経栄養因子(BDNF)と血管内皮増殖因子(VEGF)のmRNAレベルは他の全群に比べ有意に増加した。
このことから、「SB623の脳内移植と自発的運動の併用療法が、BDNFとVEGFの発現亢進を含むであろうメカニズムを通じて、脳虚血後の強固な神経学的回復と内因性の神経新生および血管新生を相乗的に促進することが示唆された」との考察を発表。
SB623の新たな可能性を示唆するデータをさらに取得することができたと同社では考えている。
③慢性期脳出血プログラム
2019年1月、「SB623」の新規適応症として、慢性期脳出血プログラムを追加することを決定した。
脳出血は、血管が詰まって引き起こされる脳梗塞に対して、血管が破れることで引き起こされる疾患で、半身麻痺、感覚障害又は記憶障害等の症状が起こるが、現状では根治治療は存在していない。
同社では、慢性期脳出血は外傷性脳損傷と類似性があることから「SB623」の新規適応症として追加することとし、国内でのフェーズ2bまたはフェーズ3からの開始を見込み、慢性期脳梗塞同様、PMDAとの協議を開始する予定である。
グローバル試験については、こちらも慢性期脳梗塞同様、自社開発あるいはパートナーリング等のオプションも視野に入れ、来期以降の開始を検討している。
④加齢黄斑変性
「SB623」は強い神経保護作用を持つと考えられることから、網膜疾患への適応可能性が期待されている。
黄斑(おうはん)とは網膜の中央にあり、ものを見るために一番重要な部分。ものの形、大きさ、色、立体性、距離などの光の情報の大半を識別している。加齢とともに徐々に網膜の細胞が死滅する結果、視力が低下したり、ものの見え方に支障が出るのが加齢黄斑変性症である。そのなかでも患者数の多いドライ型については、根本的な治療法が存在しない。
患者数が多く、新たな治療法の確立が待たれている同疾患に対して、同社は、特に加齢黄斑変性(ドライ型)および網膜色素変性をパイプラインに入れ開発を進めている。
2020年3月には、眼科用医薬品の研究開発を行い豊富な経験と高い専門性を持つOCUMENSION (HONG KONG) LIMITEDと、網膜疾患における再生細胞薬の研究開発及び事業化に関する業務提携契約を締結した。
網膜色素変性症及び加齢黄斑変性症(ドライ型)を対象疾患としたSB623細胞と視神経炎を対象疾患としたMSC2細胞を対象にして共同開発を進める考えで、加齢黄斑変性症の非臨床試験(In Vivo試験)を開始した。
眼科領域でアンメットメディカルニーズが高く巨大な人口を有する中華圏(中国本土、香港、マカオ、台湾を含む)における事業展開に向け一歩を踏み出した。
⑤がん疾患、炎症性疾患
開発品の拡大を目指し、2018年9月、間葉系幹細胞由来の細胞治療薬に関する特許ポートフォリオを取得した。
間葉系幹細胞(※)の細胞膜上に存在する特定の Toll 様受容体(※)を刺激することで、間葉系幹細胞の特徴である安全性及び忍容性を維持したまま抗炎症機能を増強する技術及び炎症機能を増強する技術に関するもの。
この技術により得られる抗炎症機能を増強した細胞「MSC2」及び炎症機能を増強した細胞「MSC1」は、通常の間葉系幹細胞と比較して、高い安全性と有効性が期待できる。
高い抗炎症作用を有する「MSC2」は、視神経炎、多発性硬化症やクラッベ病といった脱髄疾患、糖尿病性神経障害、関節リウマチ、クローン病等の炎症性疾患に対する治療薬として、炎症機能を高めた「MSC1」は、通常の間葉系幹細胞が腫瘍の成長に促進的に働くのに対し、腫瘍の成長を減衰させることが非臨床試験で確認されており、がん治療薬としてそれぞれ開発が期待できる。
「MSC2」に関しては、21年11月、米国に本社を置く再生医療企業 D&P Bioinnovations,Inc.と、サンバイオのMSC2 細胞を利用したヒトの食道組織の再生を目的とする食道再生インプラントの開発及び商業化に関する業務提携契約を締結した。
アライアンスの概要は以下の通り。
☆サンバイオは D&P社に対し、D&P社が研究している食道再生インプラントの開発及び商業化のために MSC2 細胞を使用するライセンスを非独占的かつ譲渡不可の条件で供与する。
☆その対価として、サンバイオは、将来にわたって食道再生インプラントの日本における商業化の権利とアジア地域における商業化の優先交渉権を取得する。
☆日本国外でのD&P社による販売が実現した際には、サンバイオがその売上高に応じた段階的なロイヤルティ(最大 2.5%)を D&P社から受け取る。
☆D&P社がこの食道再生インプラントのライセンスアウトを実施した場合は、ラインセンスアウトにより得た収益に対し、サンバイオ一定の利益分配(最大20%)を受領する。
☆主な費用負担については、MSC2 細胞の製造プロセスの開発にかかる費用はサンバイオが負担し、食道再生インプラントの日本以外での各地域での開発にかかる費用は D&P社が負担する。
両社は以下のようなコメントを発表し、今後の展開に期待を寄せている。
サンバイオ 森社長
「D&P は、食道再生インプラントの領域において深い知見と高い専門性を有しています。サンバイオは MSC2 細胞の供給を含む D&P との協業により、食道損傷のある患者さんに大きな利益を提供できる食道再生インプラントを開発できると確信しています」
D&PCEO Dr. Derek Dashti氏
「D&P は、再生細胞薬の研究開発のリーディングカンパニーであるサンバイオと協業して食道再生インプラントを開発できることを嬉しく思います。D&P は、人工生体材料や幹細胞を用いて損傷した組織・臓器を修復することに焦点を当てた再生医療企業です。がんや疾患、物理的外傷などでひどく損傷した食道の治療と再生を最初の適応とした当社の off-the-shelf の組織・臓器再生インプラントプラットフォームの開発を、サンバイオと協業できることを心待ちにしています。この提携は、D&P の off-the-shelf の新たな人工組織・臓器再生インプラントを活用し、再生医療の治療法の枠組みを変えるものであり、この取り組みを追及することにワクワクしています」
※間葉系幹細胞
自己再生能力をもつ多能性細胞。骨細胞、心筋細胞、軟骨細胞、腱細胞、脂肪細胞など、間葉系に属する細胞への分化能をもつ。
※Toll 様受容体
外因性の危険信号(細菌やウイルスなどの構成成分など)や内因性危険信号(組織障害に伴い放出されるタンパク質など)を認識する受容体で、主にマクロファージや樹状細胞などの自然免疫系の細胞膜に存在する。ヒトでは現在までに、認識する構造が異なる10種類のTLRの存在が確認されている。
⑥アルツハイマー型認知症
2022年11月、慶應義塾大学医学部と、開発品 SB623 のアルツハイマー型認知症を対象とした共同研究に関する契約を締結した。
(アルツハイマー型認知症概要)
脳内での老人斑(アミロイド β の斑状蓄積)及び神経原線維変化(タウの線維状凝集体)の多発を特徴とし、これらの影響で脳の神経細胞の働きの阻害や神経細胞の死滅が引き起こされると考えられている進行性の病気。
病気の進行に伴い、記憶、言語、計算、判断といった認知機能障害が症状として現れ、日常生活や社会生活に支障をきたす。
日本において、アルツハイマー型認知症は認知症の原因疾患として最も多く、アルツハイマー型認知症の患者数は、2025 年には約 450~500 万人に達し、その後も年々増加すると推計されている。
(共同研究の概要)
アルツハイマー型認知症の特徴である神経原繊維変化を再現した、ヒトiPS 細胞由来の3次元培養脳モデルを活用して、アルツハイマー病患者の病態に対するSB623の有効性評価およびそのメカニズム解析を行い、臨床試験に進む為に必要なデータの取得を目指す。
(2)製造・販売体制
今後の事業化を見据えて、製造・流通・販売体制構築をスピーディーに推進中である。
①量産化体制
再生細胞薬の実用化にあたっては、まず初めに量産化技術の確立がカギを握るが、サンバイオはすでにその点をクリアしている。
シニア・プロダクション・デベロップメント・フェローであるマイケル・マクグローガン氏は、前職において世界で初めて再生細胞薬の量産化に成功しFDAの治験承認を獲得した実績のある人物。
同氏は、サンバイオにおいて10年かけて治験実施とその後の販売に必要な量産技術の確立を成し遂げた。その量産技術は、他社の追随を許さないサンバイオ独自のものである。
また、「SB623」の臨床試験が着実に進展する中、2018年3月には日立化成株式会社(現 昭和電工マテリアルズ株式会社)グループと「SB623」の製造に関する業務提携を締結した。日立化成の子会社で再生医療等製品の受託製造事業を行うHitachi Chemical Advanced Therapeutics Solutions, LCCが保有する製造施設で、日本と米国市場向けに「SB623」の後期臨床試験用及び市販用製品を製造する(2020年4月に日立化成は昭和電工の連結子会社となり、同年10月に社名変更)再生医療関連企業で量産化まで技術を確立できている企業は非常に少ない。従来の薬に比べて構造が複雑なものを取り扱う再生医療ビジネスにおいては、実用化に至るまでに長い年月が必要で「量産化」という超え難い「死の谷」が存在する。
同社は、その「死の谷」をすでに超えているのみでなく、日立化成とのアライアンスにより商業用生産の準備にも入っており、他社を大きくリードしていると言えよう。
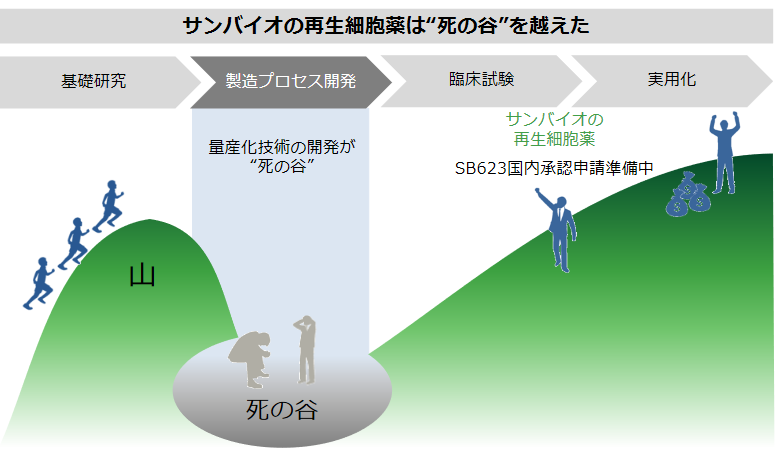
(同社資料より)
以上のように、市販後の安定供給体制構築に向けた課題を解決し2022年3月に承認申請を完了した同社は、製造プロセスを確立している。
その後、生産関連の審査に対する従前からの対応を進め、承認に向けて着実に前進してきたが、23年に入り、製造における収量に関する課題(申請時点と比較して収量が減少)が発生した。
そこで、申請時点と同等の収量は、過去の製造において複数回達成しているため、過去の製造を再現確認するという位置づけの下、課題解決のための施策を策定し、製造委託先と協同で製造オペレーションを回復・強化しながら製造に取り組んでいる。
2023年12月14日付けのリリースによると、収量に関する課題については解決し、審査は進捗しているが、審査の状況から承認取得にはもう少し時間を要するため、承認取得目標時期を2024年3月に修正した。
②流通及び販売体制
流通・販売体制についても承認・上市を見据えた体制構築が進んでいる。
再生細胞薬は医療機関にとっても流通業務を含む医療周辺企業にとっても取り扱いに未経験の事項が多く、製品特性に適した普及準備への動きを加速する必要がある。
このような状況下、サンバイオ株式会社、株式会社ケアネット(東証マザーズ、2150)、株式会社メディカルインキュベータジャパン(非上場)、株式会社バイタルケーエスケー・ホールディングス(東証1部、3151)、株式会社アステム(非上場)の5社は、再生細胞薬「SB623」の適正使用・普及、安定流通を図るために業務提携を締結し、共同研究をスタートさせることとした。
再生細胞薬の適正使用・普及に向けた研究は、サンバイオ、ケアネット、メディカルインキュベータが中心となり実施。流通の在り方の検討及び研究は、サンバイオ、バイタルケーエスケー・ホールディングス、アステムが中心となって実施する。
また、業務提携をより実効性のあるものとするために資本提携も実施する。
加えて、株式会社スズケン(東証1部、9987)と安定供給を目的とした商流に関する基本契約を締結したほか、流通管理・投与スケジュールサポートシステム「R-SAT®」の共同開発を進めており、22年4月にはスズケンと共同で特許を取得した。
「R-SAT®」は、厳格な品質管理が求められる再生医療等製品を投与される患者の登録から、再生医療等製品の輸配送、投与および投与後のフォローまでの情報を一元管理し、製薬企業、製造業者、輸配送業者、医療機関などの関係者がそれらの情報を共有できる流通管理・投与スケジュールサポートシステム。このシステムにより、医療機関においては再生医療等製品をより安心・安全に利用できる体制が整うこととなる。
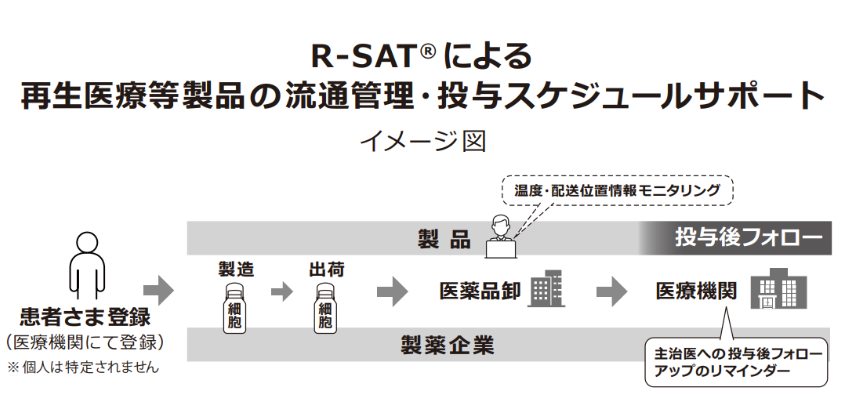
(同社資料より)
販売に関しては、バイオベンチャーの中で自社販売体制を構築している企業は数少ないが、売上・利益の最大化を追求するとともに、「SB623」を患者に適切・的確に届けることが自社の社会的責任であると考え、国内自販体制構築に向けて経験豊富な以下のキーパーソンを中心に体制を強化している。
|
役職・氏名 |
経歴など |
| 常務執行役員 人事、信頼性保証・薬事、日本・アジア事業担当
束原 直樹氏 |
日本イーライリリー株式会社などで、骨粗鬆症などの様々な治療領域において、複数の製品のグローバルおよび日本での上市や事業再生を成功させたほか、アボットジャパン合同会社では、営業組織の拡大と顧客ターゲティングなどをリードし、主要製品の売上拡大、事業開発の推進で実績を上げた。日本で SB623 を上市するための準備及び上市後の体制構築、並びにアジアでのビジネス展開においてオペレーション業務全般の指揮を執る。 |
| 執行役員 生産部長
中田 圭三氏 |
参天製薬株式会社などでグローバルの生産工場の統括責任者として、中国工場の立上げや、生産性向上と共に供給能力の強化を統括。大幸薬品株式会社では短期間での工場の立上げに加え、物流、品質管理、エンジニアリング技術も統括し、自社製造品と委託製造業者製造品双方のサプライチェーン全体を指揮。医薬品の品質と生産を両輪に、安定供給に関する豊富な知識と現場経験を有す |
| 信頼性・薬事部長
(総括製造販売責任者) 澤口 和美氏 |
エーザイ株式会社、ヤンセンファーマ、第一三共株式会社等で医薬品開発のプロジェクトリーダーとして活躍、その後CROや複数の製薬企業で品質及び薬事責任者を歴任。国内の薬事責任者として、治験相談や申請に係る当局対応の中心的役割を担い、SB623国内上市を薬事と品質面から強力に推進する。 |
<国内販売の準備状況>
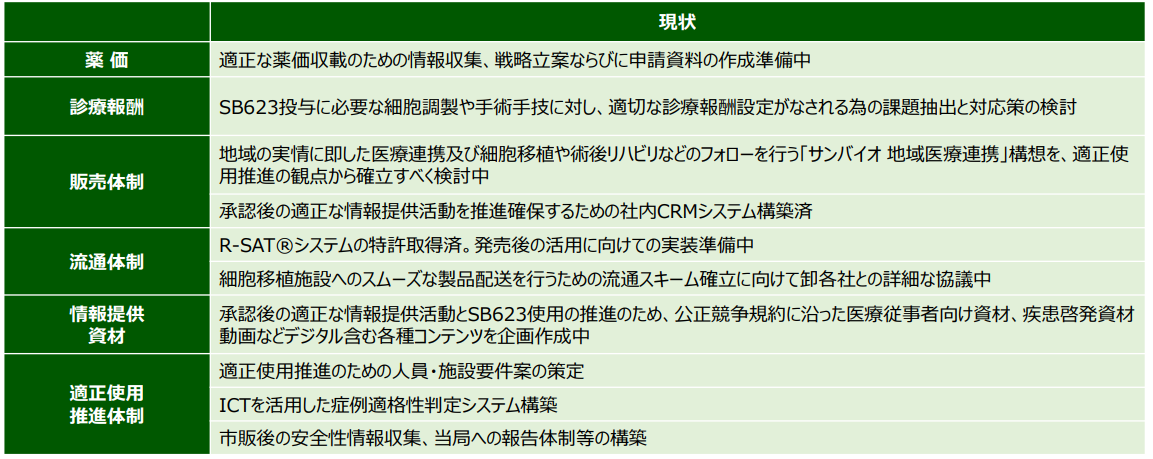
2022年3月の製造販売承認申請前より、国内での発売までに実施すべき項目として、販売体制の構築、流通体制の構築、情報提供資材の作成、薬価、適正使用推進体制の構築、診療報酬への対応、エビデンスの発信などを進めてきた。
想定される承認要件(製造販売後調査、適正使用推進など)に沿った販売体制の準備を進めている。パートナー企業や自治体など様々な外部ステークスホルダーと連携し、上市後は速やかに慢性期外傷性脳損傷患者に貢献できる体制を構築に取り組んでいる。
(同社資料より)
これらの項目のうち、最もリソースを投入している販売体制の構築においては、急性期・回復期を経て、維持期に移行した運動機能障害のある頭部外傷患者と医師との接点、つまり「患者がどこにいるのか」を把握することが販売拡大において重要なポイントとなる。
そのための実態調査を実施したところ、これまでに以下のような事実が明確になってきた。
*慢性期では有効な治療法が存在せず、多くの患者が病院を受診しなくなる。
*各診療科の全ての医師が、慢性期の頭部外傷患者を診療しているとは限らない。
*患者を診ている医師と、細胞移植する医師が異なる。
*在宅のみという患者が約5割
*医療保険・介護保険を利用し2次救急施設の脳神経外科、整形外科、リハビリ科などに通院している患者が多い
こうした治療実態の明確化を経て、治療フェーズ毎の医師や患者の考え方に基づく戦略の立案や、術前・術後の患者フォローを軸とした地域ごとの活動の戦略策定を進めている。
流通体制の構築においては、再生医療医薬品の製品トレーサビリティを含めた患者登録システムの実現を目指したR-SAT®システムの実装準備を、アライアンス先であるスズケンとともに進めている。
「SB623」を低温で保管・運搬するための液体窒素を使用した特殊なシステムの構築も完了し、万全の準備を進めている。
R-SAT®システムは、再生医療等製品の管理システム及び再生医療等製品の管理方法に関する共同特許を取得した。
また、2022年12月には、再生医療等製品の包装・表示・保管に関する自社施設の設置及び業許可を取得した。
流通体制の構築を進める中で、医療機関のニーズに柔軟に対応するためには自社施設の設置が必要と考えたため。
品質管理体制に対する審査を経て、再生医療等製品の包装・表示・保管に関する業許可を取得したことにより、同施設での再生医療等製品の包装・表示・保管が可能になり、適切な流通体制の整備が進んでいる。
③グローバルリーダーを目指した体制づくり
同社グループは、「日本発、再生医療分野のグローバルリーダー」を目指している。
「SB623」に事業化にあたっては、常務執行役員CMO(チーフ・メディカル・オフィサー):ビジャン・ネジャドニク医師、常務執行役員 人事、信頼性保証・薬事、日本・アジア事業担当:束原直樹氏など、製薬業界・再生細胞薬分野で世界的な経験・実績を積み各地域での開発や商業化に精通した人材を配置している。
加えて、これら経営メンバーを支え、実務を牽引する経験豊富なシニアリーダーも国内外で積極的に採用し、組織基盤を強化しており、こうした体制によりグローバルリーダーを目指していく。
3.今後の事業目標と目指す姿
(1)「製薬企業への脱皮」と
「グローバルリーダーへの成長」
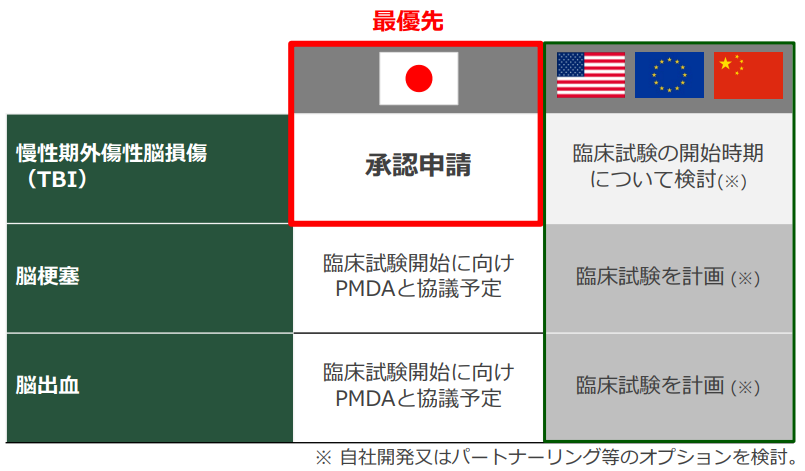
2022年3月、慢性期外傷性脳損傷プログラムについて国内製造販売承認申請を行った。
承認取得及びその後の販売を見据え、前述のように製造体制および国内自販体制構築を進めており、可能な限り早期に再生細胞薬を販売する製薬企業へ脱皮する。
従来通り、国内慢性期外傷性脳損傷プログラムを最優先し、その後、脳梗塞と脳出血の国内臨床試験へと進む計画だ。
SB623の価値最大化を達成するためのグローバルローンチの実現、グローバル製品供給体制の確立と、開発品の導入やM&Aによるパイプラインの強化を図り、グローバルリーダーへと成長することを目標としている。
(同社資料より)
(2)成長戦略を阻害する
主なリスクとその対応策
成長戦略を阻害する主なリスクとしては、「再生細胞薬という新薬開発の不確実性」と考えている。
臨床試験で有用な効果が発見できなかったり、製造プロセスの確立が予定通り進行せず開発等の中止や延期になったりした場合には、事業モデルや資金面での見直しが必要となり、成長戦略を阻害する大きな要因となる。
こうしたリスクに対しては、複数のパイプライン・インディケーションをバックアップに保有するほか、日本の早期承認制度のような制度を利用するなど開発期間の短縮や開発コストの低減を図る戦略により開発等を進める考えだ。
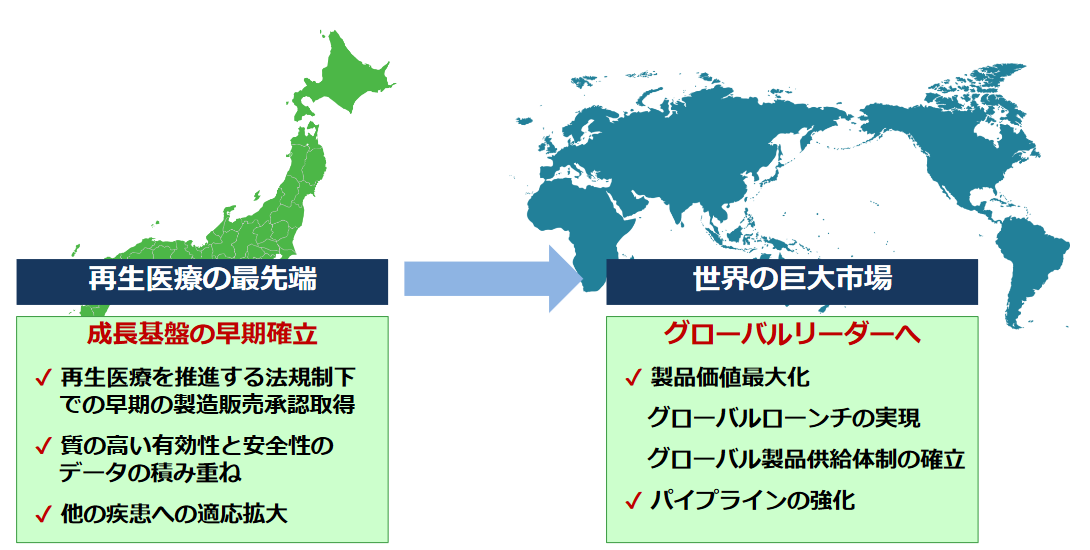
(3)今後の展開と目指す姿
国内において、SB623慢性期外傷性脳損傷プログラムの承認・自社販売開始とともに、SB623脳梗塞プログラム及び脳出血プログラムの臨床開発を目指す。
その後、地域展開として、SB623慢性期外傷性脳損傷プログラム、慢性期脳梗塞プログラム及び脳出血プログラムの欧米・アジアなどでの地域展開を図る。
また、脳出血、加齢黄斑変性、網膜色素変性など、「適応疾患の拡大」も進め、「SB623」の価値最大化を図る。
加えて、「SB623」以外のパイプライン開発にも取り組み、日本発の再生医療グローバルNo.1企業を目指す。
(同社資料より)
4.業績動向
(1)2024年1月期第3四半期
決算概要
①連結業績概要
|
23/1月期3Q |
24/1月期3Q |
前年同期比 |
|
|
事業収益 |
– |
– |
0 |
|
事業費用 |
6,404 |
3,725 |
-2,678 |
|
うち、研究開発費 |
4,981 |
2,447 |
-2,534 |
|
営業利益 |
-6,404 |
-3,725 |
+2,678 |
|
経常利益 |
437 |
-1,837 |
-2,274 |
|
四半期純利益 |
-1,758 |
-1,883 |
-125 |
*単位:百万円
前年同期比同様、事業収益の計上は無かった。
営業損失は前年同期比26億78百万円縮小の37億25百万円。慢性期外傷性脳損傷プログラムの承認に向けた製造関連の費用を中心に、研究開発費24億47百万円を計上した。
経常損失は同22億74百万円拡大の18億37百万円。為替差益が前年同期の68億85百万円から19億12百万円に縮小した。
②財務状態
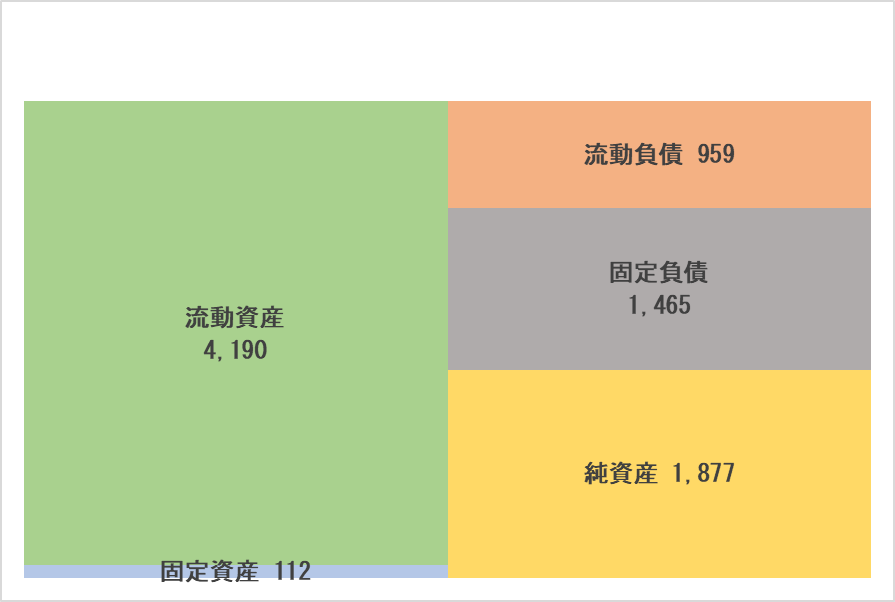
◎主要BS
|
23年1月末 |
23年10月末 |
23年1月末 |
23年10月末 |
||
|
流動資産 |
6,967 |
4,190 |
流動負債 |
1,090 |
959 |
|
現預金 |
6,732 |
3,806 |
短期借入金 |
268 |
286 |
|
固定資産 |
77 |
112 |
固定負債 |
1,525 |
1,465 |
|
有形固定資産 |
47 |
44 |
負債合計 |
2,616 |
2,425 |
|
無形固定資産 |
1 |
43 |
純資産 |
4,428 |
1,877 |
|
投資その他の資産 |
28 |
24 |
株主資本 |
8,347 |
7,469 |
|
資産合計 |
7,045 |
4,302 |
利益剰余金 |
-8,177 |
-1,188 |
|
負債純資産合計 |
7,045 |
4,302 |
*単位:百万円
*株式会社インベストメントブリッジが開示資料を基に作成。
現預金の減少などで資産合計は前期末に比べ27億円減少。負債はほぼ変わらず。純資産は同25億円減少。この結果自己資本比率は前期末の56.5%から22.0ポイント低下し34.5%となった。
(2)2024年1月期業績予想
*連結業績予想
|
23/1月期 |
24/1月期 予想 |
前期比 |
|
|
事業収益 |
– |
– |
0 |
|
事業費用 |
7,899 |
4,642 |
-3,257 |
|
営業利益 |
-7,899 |
-4,642 |
+3,257 |
|
経常利益 |
-4,698 |
-4,597 |
+101 |
|
当期純利益 |
-5,559 |
-4,598 |
+961 |
*単位:百万円。予想は会社側発表
業績予想に変更は無い。SB623慢性期外傷性脳損傷プログラムの国内承認取得目標時期を24年3月に修正したが、審査対応を引き続き進める。
並行して、承認取得後を見越して、SB623の国内普及に向けた製造・物流・販売体制の構築も着実に進め、その後は、国内でのSB623脳梗塞プログラムや脳出血プログラムの臨床試験の開始に向けて取り組む。
一方で、費用の管理も厳しく行っていく。資金投下を集中的に行ってきたSB623慢性期外傷性脳損傷プログラムの製造販売承認活動においては、活動の成果は維持しつつ大幅な費用削減を図る。また、これ以外の活動に関しても、徹底した費用削減を行っていく予定である。
為替の前提は138.00円/USD(前期は132.72円/USD)。
5.今後の注目点
収量に関する課題については解決し、審査は進捗しているものの、審査の状況から承認取得にはもう少し時間を要するため、残念ながら承認取得目標時期を来期、24年3月に修正した。
早期の承認取得を期待したい。
<参考:コーポレート・ガバナンスについて>
◎組織形態及び取締役、監査役の構成>
| 組織形態 | 監査役設置会社 |
| 取締役 | 3名、うち社外1名 |
| 監査役 | 3名、うち社外3名 |
◎コーポレート・ガバナンス報告書
最終更新日:2023年5月11日
◎基本的な考え方
当社は、コーポレート・ガバナンスの充実を経営の重要課題であると認識しており、内部経営監視機能の充実と適切な情報開示による透明性の高い経営を確保することで、経営環境の変化する中における永続的な発展と成長、持続的な企業価値の最大化に努めております。また、株主をはじめとするすべてのステークホルダーからの信頼を得るため、経営の健全性・効率性・透明性を確保すべく、最適な経営管理体制の構築に努めてまいります。
◎コーポレートガバナンス・コードの各原則を実施しない理由
当社はコーポレートガバナンス・コードの基本原則をすべて実施しておりますので、本欄に記載すべき事項はありません。

