クリングルファーマ(4884) 脊髄損傷急性期の組入れ終了に期待
|
 安達 喜一 社長 |
クリングルファーマ株式会社(4884) |
 |
企業情報
|
市場 |
東証グロース市場 |
|
業種 |
医薬品(製造業) |
|
代表取締役社長 |
安達 喜一 |
|
所在地 |
大阪府茨木市彩都あさぎ 7-7-15 彩都バイオインキュベータ 207 |
|
決算月 |
9月 |
|
HP |
株式情報
|
株価 |
発行済株式数 |
時価総額 |
ROE(実) |
売買単位 |
|
|
1,319円 |
5,380,700株 |
7,097百万円 |
-12.5% |
100株 |
|
|
DPS(予) |
配当利回り(予) |
EPS(予) |
PER(予) |
BPS(実) |
PBR(実) |
|
0.00円 |
– |
-177.50円 |
– |
517.75円 |
2.5倍 |
*株価は3/3終値。発行済株式数、DPS、EPSは23年9月期第1四半期決算短信より。ROE、BPSは前期実績。
業績推移
|
決算期 |
売上高 |
営業利益 |
経常利益 |
当期純利益 |
EPS |
DPS |
|
2019年9月(実) |
– |
-371 |
-301 |
-302 |
-290.14 |
0.00 |
|
2020年9月(実) |
467 |
-171 |
-116 |
-117 |
-106.70 |
0.00 |
|
2021年9月(実) |
289 |
-357 |
-299 |
-301 |
-72.51 |
0.00 |
|
2022年9月(実) |
391 |
-426 |
-330 |
-331 |
-68.33 |
0.00 |
|
2023年9月(予) |
68 |
-993 |
-953 |
-955 |
-177.50 |
0.00 |
*単位:百万円、円。予想は会社側予想。
クリングルファーマ株式会社の会社概要、開発の進捗、業績動向などをお伝えします。
目次
今回のポイント
1.会社概要
2.開発の状況
3.成長戦略
4.業績動向
5.今後の注目点
<参考:コーポレート・ガバナンスについて>
今回のポイント
- 組織や臓器を「保護」「再生」「修復」する機能を併せ持つHGF(Hepatocyte Growth Facto肝細胞増殖因子)を使った難治性疾患治療薬の研究開発を行っている創薬バイオベンチャー。臨床試験の成果をより確実に医薬品として社会実装すること及び中長期的な収益の最大化を図るために、「自社開発・販売モデル」を中心に位置づけつつ、事業化のスピードや確実性も考慮し、「導出・共同開発モデル」「原薬供給モデル」も組み合わせて事業を推進している。「適応拡大」「海外市場開拓」によって中長期の売上・利益の成長を目指している。
- 現時点で臨床試験までステージが進んでいる自社パイプラインは4件(脊髄損傷急性期、声帯瘢痕、ALS、急性腎障害)。「原薬供給モデル」により米国クラリス・バイオセラピューティクス社(以下、クラリス社)が臨床試験を実施しているパイプラインが1件(眼科疾患)。このうち、第Ⅱ相以降のいわゆるレイトステージにあるのは、脊髄損傷急性期(第Ⅲ相実施中)、声帯瘢痕(第Ⅲ相実施中)、ALS(第Ⅱ相実施中)の3件。現在はこの3疾患を対象とした医薬品開発に注力し、製造販売承認を得ることにリソースを集約している。開発が最も進んでいる脊髄損傷急性期については2023年前半に第Ⅲ相試験の患者組入れ完了、2023 年後半に最終症例の経過観察終了を見込んでおり、2025年9月期以降は、恒常的な製品売上により黒字化達成を目指す考えだ。
- 23年1月に、脊髄損傷急性期に対する第III相臨床試験で目標症例数の9割超の組入れを完了したほか、声帯瘢痕に対する第III相臨床試験で第一例目の症例を登録するなど、開発は着実に進展していることが確認できた。引き続き、「脊髄損傷急性期の組入れ終了→約半年後の2023年中の最終症例の経過観察終了→統括報告書発行」の順調な進展に期待したい。
1.会社概要
HGF(Hepatocyte Growth Facto肝細胞増殖因子)を使った難治性疾患治療薬の研究開発を行っている創薬バイオベンチャー。臨床試験の成果をより確実に医薬品として社会実装すること及び中長期的な収益の最大化を図るために、「自社開発・販売モデル」を中心に位置づけつつ、事業化のスピードや確実性も考慮し、「導出・共同開発モデル」「原薬供給モデル」も組み合わせて事業を推進している。「適応拡大」「海外市場開拓」によって中長期の売上・利益の成長を目指している。
【1-1 上場までの沿革】
2001年12月、「難治性疾患=症例数が少なく、原因不明で、治療法が確立しておらず、生活面への長期にわたる支障がある疾患」に対する治療薬の研究開発を目指す大学発バイオベンチャーとして設立。
2005年5月、中村敏一氏(当時:大阪大学大学院医学系研究科教授)が発見したHGFタンパク質の開発実施権の許諾を得て、新規パイプラインとして開発を開始。
2007年6月、組換えDNA技術を応用した組換えヒトHGFタンパク質の製造法を確立。非臨床試験の実施を経て、欧米及び日本において、皮膚潰瘍、慢性腎不全、ALS、脊髄損傷急性期、声帯瘢痕など、複数の疾患についての臨床試験を実施。
2018年6月、組換えヒトHGFタンパク質を株式会社リプロセルより研究用試薬として販売を開始。
同年10月、日本における、脊髄損傷急性期患者を対象とした第I/II相試験を終了。その結果、組換えヒトHGFタンパク質の医薬品としての安全性に加え、有効性を示唆する結果を得ることができた。
2019年9月、厚生労働省が脊髄損傷急性期を対象とする組換えヒトHGFタンパク質を希少疾病用医薬品として指定。
2020年12月、研究開発資金の調達を通じた成長スピードの加速を目指し、東証マザーズに上場。
2022年4月、市場再編に伴い東証グロース市場に移行した。
【1-2 理念】
以下のような「企業理念」、「VALUE:行動指針」を掲げている。
◎企業理念
「難治性疾患治療薬の研究開発を行い、難病に苦しむ患者さんに対して画期的な治療手段を提供し社会に貢献する」
◎VALUE:行動指針
|
1 |
私たちは、人々の健康を支える重要な仕事に携わっていることを常に自覚し、誇りと責任をもって行動します。 |
|
2 |
私たちは、「病に苦しむ世界中の患者さんを助ける」、その為に今何をなすべきかを常に考えます。 |
|
3 |
私たちは、企業が社会的存在であり、多くの人々の支援によって支えられていることを忘れず、決して社会から非難されたり、誤解を受けたりするような行動をしないよう自らを厳しく律していきます。 |
【1-3 同社を取り巻く環境:創薬ベンチャーと再生医療支援】
製薬業界では、高齢化に伴う医療費の増大に対応したジェネリック医薬品による代替が進むとともに、薬価改定期間が短縮され、高額医薬品の薬価が著しく低下している。
また、臨床試験の大規模化等に起因する新薬開発のためのコスト増大により、国内外での製薬企業の合従連衡が進みM&Aにより企業規模が拡大しているほか、自社創薬開発において重点領域の絞込みが行われており、社外から開発品目を導入する動きも活発化している。
一方、新薬開発については、開発対象の中心が、対象患者が多く、将来安定した多額の収益が得られるいわゆるブロックバスター医薬品から、特定の患者群に効果的な治療が行える医薬品の開発に移行し、経営資源が特定分野に集中している。
このため、短期に意思決定が行われる創薬ベンチャーがその中心的役割を担うと言われている。
こうした製薬業界における動きに対し、日本政府は創薬ベンチャー支援の取り組みとして、医療系ベンチャー・トータルサポート事業(MEDISO)の開始や「伊藤レポート2.0 バイオメディカル産業版」の作成、条件付き早期承認制度や先駆的医薬品指定制度の法制化など、近年、極めて積極的な対応を見せている。
特に、再生医療の実用化に向けた環境整備は急速に進展している。
再生医療とは、「損傷を受けた生体の機能を、化合物である薬で治療するのではなく、タンパク質や細胞など元々人体を構成する物質を用いて、復元または活性化させる医療」のこと。
アンメットメディカルニーズ(いまだ有効な治療方法がない疾患に対する医療ニーズ)の高い疾患に対する根本的な治療を可能にするため、高齢化、技術革新、規制緩和といった追い風を受け、再生医療市場の顕在化が進むと言われている。
日本政府は「再生医療」を日本再興戦略の重要テーマの一つとして位置付けており、前述の早期承認制度や先駆的医薬品指定制度はそうした動きに基づいて導入されたもので、日本の再生医療への取り組みは世界が注目するところとなっている。
再生医療には、大きく分けて、造血系、骨格筋、神経などの幹細胞の増殖・分化機能を利用する「細胞移植療法」と、細胞の増殖を促進する増殖因子を用いた「増殖因子の補充療法」の2つがある。
クリングルファーマが手掛ける「HGF」は「増殖因子の補充療法」の中でも、想定される疾患範囲の広さ、経済効果の大きさ等から特に重要な増殖因子と位置付けられている。
*医療系ベンチャー・トータルサポート事業(MEDISO)
薬機法(医療機器等の品質、有効性及び安全性の確保等に関する法律)の対象となる医薬品・医療機器・再生医療等製品、新たな創薬技術や医療用マテリアル等の実用化を目指している個人を含めたベンチャー、アカデミアを対象に、事業計画、資金調達、法規制対応などを通じて実用化を支援する厚生労働省の委託事業。
*伊藤レポート2.0 バイオメディカル産業版
グローバルに活躍するバイオベンチャーの創出を通じて、いち早く世界中の患者に治療法を届けることを目的とし、経済産業省が立ち上げた「バイオベンチャーと投資家の対話促進研究会」における報告書。日本の上場創薬型ベンチャーの時価総額が海外よりも小さく、また、柔軟かつ機動的な資金調達ができない状況にあることを踏まえ、(1)創薬型ベンチャーと投資家の対話を促進する共通言語の策定、(2)新興市場の現状と課題の提示の2点を通じて、上場後も含めた資金調達環境の改善に向けた方向性を示している。
*条件付き早期承認制度
患者数が少ないなどの理由で臨床第Ⅲ相試験などの検証的臨床試験を行うことが難しい医薬品・医療機器・再生医療等製品について、発売後に有効性・安全性を評価することを条件に承認する制度。
*先駆的医薬品指定制度
世界に先駆けて開発され、早期の治験段階で著明な有効性が見込まれる医薬品等を指定し、各種支援による早期の実用化(例えば、医薬品では通常の半分の6か月間で承認)を目指す制度。
【1-4 HGFとは】
同社の事業を理解するには、創薬シーズである「HGF」及び「組換えヒトHGFタンパク質」についての知識が必要である。
(1)HGF
HGF(国際一般名称:Oremepermin Alfa、オレメペルミン アルファ)は、人間の体内に存在するタンパク質。肝臓を構成している細胞である「肝細胞」の増殖を促進する増殖因子であり、日本で発見された。
増殖因子は細胞の表面に存在する受容体と結合することにより、細胞の核(遺伝子)にシグナルを伝達し、細胞の増殖開始のスイッチをオンにする物質である。
HGFはその後の研究によって、細胞増殖以外にも細胞保護、形態形成等の生物活性、つまり、組織や臓器を「保護」「再生」「修復」する機能を併せ持つことが明らかになった。
また、対象となる細胞も肝細胞だけでなく、腎臓、肺、皮膚、神経等の細胞に対して効果があることもわかってきた。
特に、線維成分の蓄積により細胞の機能が低下する「線維化」や「硬化」を解除する作用(抗線維化)及び神経細胞・グリア細胞等の神経系細胞に対する生物活性が明らかになると、複数の難治性疾患に対する治療薬の候補として様々な研究成果が報告されるようになった。
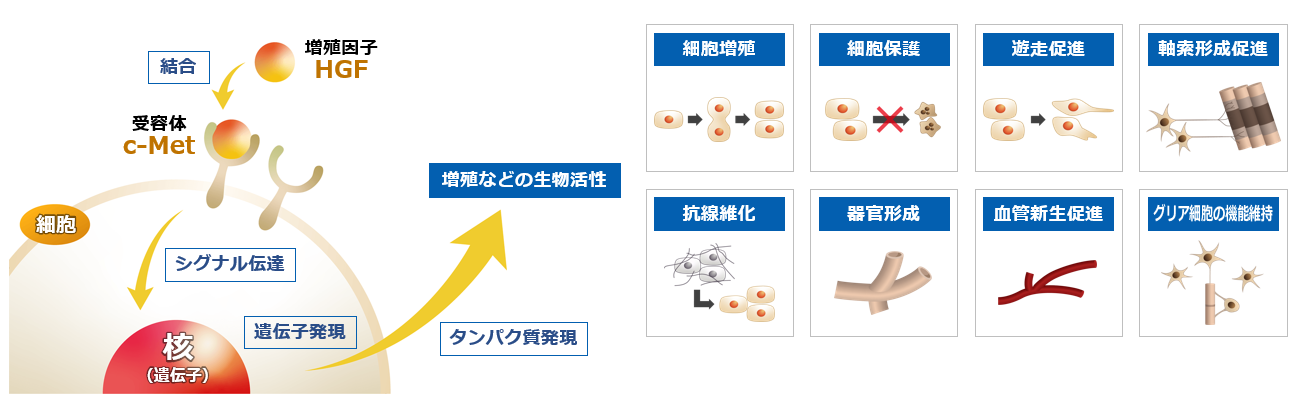
(同社資料より)
(2)組換えヒトHGFタンパク質
HGFは体内には微量しか存在しないため、人間の血液から精製して治療薬として利用することはできない。
同社は、HGFの発見者である中村敏一氏(当時:大阪大学大学院医学系研究科教授)より2005年に組換えヒトHGFタンパク質の開発実施権の許諾を受け、HGFを開発パイプラインとして導入し、組換えDNA技術を応用して「組換えヒトHGFタンパク質」として製造する方法を確立した。
HGFの培養から精製工程を確立し、かつ医薬品として認められるGMPグレード(※)で製造することができるという点が、同社の強み、優位性である。
※GMP(Good Manufacturing Practice)
医薬品を製造する際は、定められた品質規格に適合することを確認するだけでなく、製造する過程についても適切に管理し、品質の良い優れた医薬品を恒常的に製造する必要がある。このような医薬品を製造するための要件をまとめたものがGMP(Good Manufacturing Practice)、「医薬品の製造管理及び品質管理の基準」である。
組換えヒトHGFタンパク質を用いた研究は現在でも多くの疾患領域について行われており、以下のような疾患について臨床応用の可能性がある。
太字は現在同社が医薬品開発に取り組んでいる疾患である。詳細は後述。
|
疾患臓器 |
疾患名 |
生物活性 |
|
腎臓 |
急性腎障害・慢性腎不全・腎移植・糖尿病性腎症 |
腎上皮細胞の保護・増殖、 尿細管細胞の保護・増殖、形態形成誘導 筋線維芽細胞の増殖抑制、線維化成分の抑制 |
|
肝臓 |
急性肝炎・劇症肝炎・肝硬変・胆道閉鎖症・脂肪肝・肝移植 |
肝細胞、肝芽細胞の保護・増殖 |
|
心臓・血管 |
血管障害(閉塞性動脈硬化症・血管再狭窄防止等)・心筋梗塞・拡張型心筋症 |
心筋細胞の増殖 血管内皮細胞の保護・増殖、形態形成誘導 |
|
神経系 |
ALS・脊髄損傷急性期・脳梗塞・パーキンソン病・ハンチントン病・認知症 |
神経細胞の保護、軸索形成誘導 グリア細胞の保護 |
|
肺・気管支 |
慢性閉塞性肺疾患(COPD)・肺線維症・気管支喘息 |
肺上皮細胞の保護・増殖 気管支上皮細胞の保護・増殖 |
|
その他 |
皮膚潰瘍・声帯瘢痕・炎症性腸疾患・角膜損傷 |
各種細胞の保護・増殖、形態形成誘導 筋線維芽細胞の増殖抑制、線維化成分の抑制 |
【1-5 事業内容】
(1)基本戦略
希少疾患を主な対象疾患とし、組換えヒトHGFタンパク質の研究開発によって創薬イノベーションを起こすことが事業機会の創出・獲得につながると考え、組換えヒトHGFタンパク質プロジェクトに経営資源を集中し、事業を展開している。
希少疾病を主な対象疾患とするのは、「難治性で医療上の必要性が高く新薬を開発する医学的・社会的意義が大きい」「患者数が少ないため市場性の点などにより大手製薬企業での開発が進まず有効な医薬品、治療法が少ない」「バイオ医薬品は高薬価になるので事業性は高い」といった社会的な意義及び事業の将来性を見据えてのものである。
また、小規模な臨床試験による開発が可能であるため、ライセンスアウトではなく、自社開発による収益の最大化を追求できること、希少疾病用医薬品指定制度によるメリット(助成金、優先審査、再審査期間の延長等)を享受できることなどもその理由である。
(同社資料より、自社開発を推進することによる収益の最大化のイメージ図)
(2)ビジネスモデル
対象疾患や提携先に応じて「A:自社開発・販売モデル」「B:導出・共同開発モデル」「C:原薬供給モデル」を組み合わせたハイブリッド型の事業モデルを志向している。
臨床試験の成果をより確実に医薬品として社会実装すること及び中長期的な収益の最大化を図るために、「A:自社開発・販売モデル」を中心に位置づけつつ、事業化のスピードや確実性も考慮し、「B:導出・共同開発モデル」も組み合わせて事業を推進し、中長期的な収益の最大化を図っていく。
臨床段階のパイプラインでは、脊髄損傷急性期と声帯瘢痕はAとBのハイブリッド(自社開発と販売提携)、ALSと急性腎障害はBによる事業化を目指している。また、クラリス社への原薬供給(後述)は「C:原薬供給モデル」に該当し、「HGF再生治療薬のプラットフォーマー」である同社ならではのビジネスモデルである。
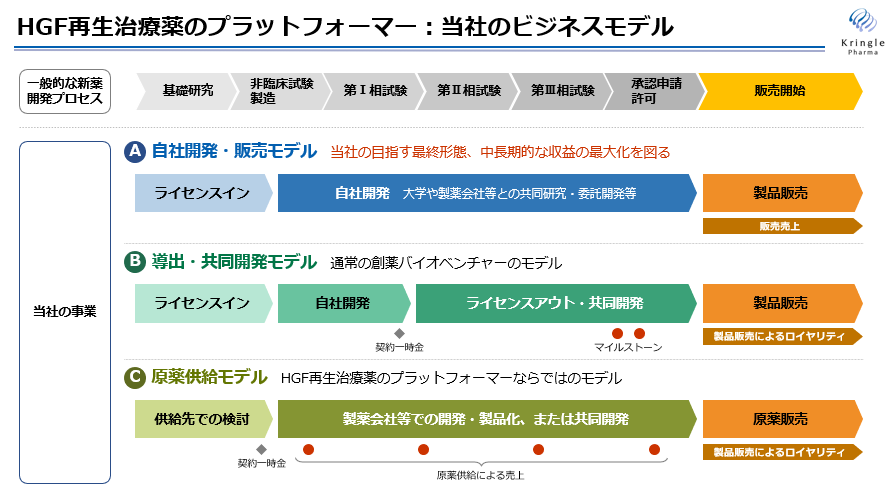
(同社資料より)
◎収益の種類及び現在の契約先
同社が収受する収益の種類は以下の通り。
|
種類 |
概要 |
|
契約一時金 |
製品販売に関する卸業者との契約時に得られる一時金 販売促進活動協力を目的として契約時に得られる一時金 原薬供給に関する契約時に得られる一時金 |
|
マイルストーン |
研究開発の進捗により受取る収益 |
|
ロイヤリティ |
製品販売後に販売額の一定比率を受取る収益 |
|
研究協力金 |
研究開発に対する経済的援助として受取る収益 |
|
販売売上 |
医薬品製造販売(製品販売)に対する売上 原薬供給による売上 試薬販売による売上 |
現時点では、以下3社とバリューチェーン及び原薬供給契約を締結している。
*脊髄損傷急性期を対象とした製品(KP-100IT)のバリューチェーンに関する契約
|
契約先 |
契約期間 |
契約内容 |
|
東邦ホールディングス(株) |
2020年2月21日からクリングルファーマ株式を保有する期間中 |
出資契約の付帯条項として、東邦ホールディングス及びそのグループ会社に対し、国内における本製品の独占的卸売販売権を許諾する。 |
|
丸石製薬(株) |
2020年8月28日から本製品の発売開始後15年間 |
丸石製薬に対し、国内における本製品の販売及びプロモーションを行う独占的権利を許諾する。
クリングルファーマは許諾の対価として、以下を収受する。 ・契約一時金:契約締結時に受領済。 ・開発マイルストーン収入:製造販売承認申請時、薬価収載時(先駆指定審査制度の対象品目に指定された場合は一部を先行して受領)及び適応追加承認時に受領する。 ・販売マイルストーン収入:売上が年間で一定額を達成した際に受領する。 ・販売後ロイヤリティ収入:年間売上に一定の料率を掛けた金額を本製品の販売日から15年が経過するまで受領する。 ・クリングルファーマは本製品を製造し、商業販売する全量を、薬価に一定率を乗じた単価で同社に販売する。 |
*組換えヒトHGFタンパク質(KP-100)の供給契約
|
契約先 |
契約期間 |
契約内容 |
|
クラリス・バイオセラピューティクス社(米国) |
2020年4月13日からクラリス社が技術アクセスフィーを支払っている期間中 |
クラリス社に対し、眼科領域におけるKP-100を有効成分とした医薬品の開発、製造、販売、輸出入等を全世界で行うための独占的実施権を許諾する。
クリングルファーマは許諾の対価として、以下を収受する。 ・契約一時金(受領済) ・技術アクセスフィー収入:クラリス社が実施する最初の臨床試験における初回投与を起点として、毎年定額を受領する。 ・クリングルファーマはクラリス社による開発(非臨床及び臨床試験)に必要なKP-100を定額の単価で販売する。 |
(3)事業化のプロセス
治療薬の開発を実現するプロセス及び同社の取り組みは以下の通りである。
①開発
①-1 基礎研究
医薬品の候補となるシーズの探索は長期の研究期間が必要である上に、この段階で候補が見つかっても医薬品として成功する確率は非常に低い。
同社では、基礎研究として、組換えヒトHGFタンパク質の新規適応症や新規候補品の探索を行っているが、大学との共同研究において専門的な知識を活用することにより、成功確率を高めるべく基礎研究を行っている。
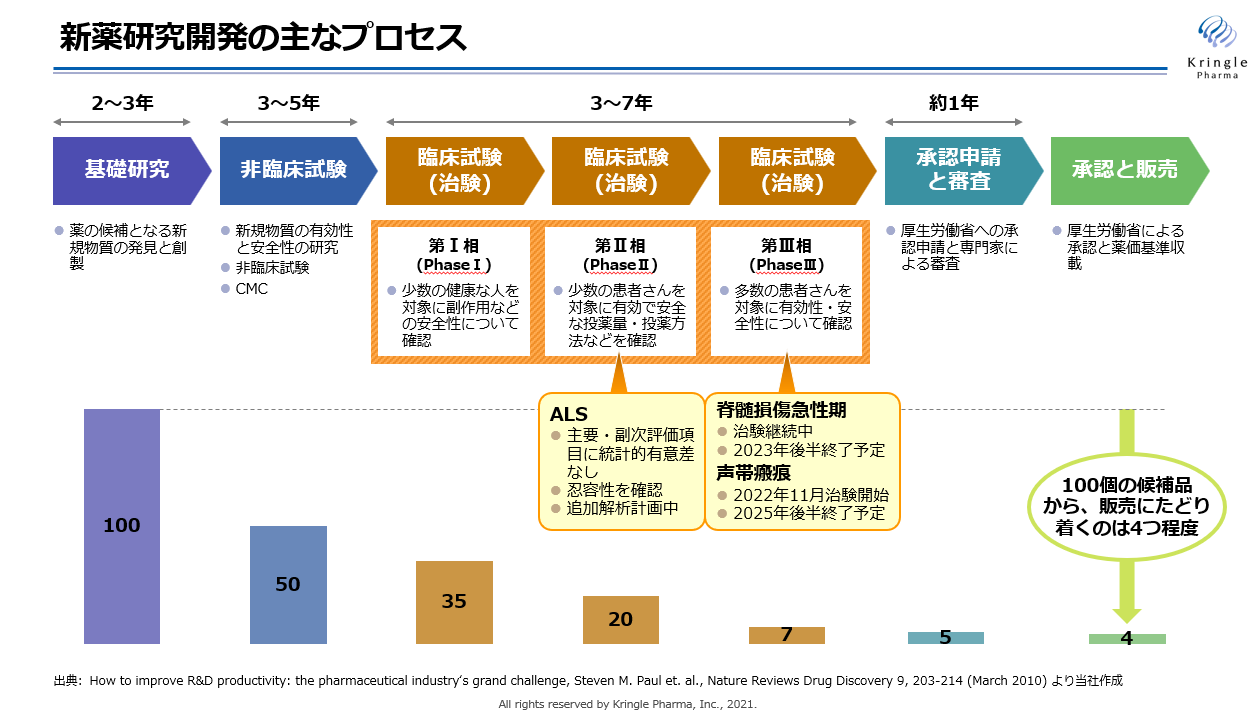
(同社資料より)
①-2 非臨床試験・製造
非臨床試験や製造については、スピードを重視し、開発業務受託機関、製造受託機関等の専門技術を活用している。
また、この段階では膨大な支出に対する収入が得られないため、公的資金(助成金、補助金)
を活用して自社負担を減らし、経済的なリスクを低減させている。
①-3 臨床試験
患者数の少ない難治性疾患では、疾患の原因も病態も明らかでないことがあり、臨床試験の評価項目の設定や症例の選定等が難しい。
そこで同社では、大学との連携により、難治性疾患に対する専門的な知見を集積し、小規模で成功確度が高い評価項目を策定し臨床試験を実施している。臨床試験の一部の業務については、開発業務受託機関に委託して品質・開発速度を確保するとともに、臨床評価や解析については、専門病院及び大学病院の医師と連携して科学的な質を高めている。
また、大学病院等が公的資金を確保し、臨床試験(医師主導治験)の実施を希望する場合には、治験薬及び科学的な情報・知識を提供して治験推進に協力し、成果の独占的な利用許諾を得ている。
①-4 承認申請・許可
臨床試験の成果をより確実に医薬品として社会実装するため、自社での医薬品製造販売承認申請を行うことを基本方針としている。
同社は難治性疾患を対象として開発しているため、POC(プルーフ・オブ・コンセプト:研究開発中である新薬候補物質の有用性・効果が、動物もしくはヒトに投与することによって認められること)が得られた後には厚生労働省の「希少疾病用医薬品指定」を受け、開発費用の助成、優先審査の活用などにより申請までの業務を加速することが可能である。
また、「条件付き早期承認制度」「先駆的医薬品指定制度」等の制度を活用することにより申請・審査に係る時間を短縮し、早期承認を目指す。
①-5 販売
難治性疾患は高度医療機関において治療が行われるため、開発した医薬品の取り扱い施設の数が限定される。このため、通常の医薬品のような大規模な流通販売網の構築が不要であり、加えて、競合する医薬品が少ないことから営業活動に大きな費用をかける必要もない。
こうした理由から、同社では医薬品製造販売業の許可を取得し、医薬品卸売販売業者と提携することで必要な場所に必要な医薬品を届けるサプライチェーンの構築が可能。その結果、販売コストの低減を通じて、高利益率の粗利益を継続的に獲得することができる。
なお、脊髄損傷急性期を対象とした製品については、現時点ではクリングルファーマ内に営業販売体制がないことから、救急領域のスペシャリティファーマ(特定の領域に特化している製薬会社)として国内の救急病院をカバーする営業体制を有している丸石製薬株式会社及び国内大手医薬品卸である東邦ホールディングス株式会社との提携によりサプライチェーンを構築している。
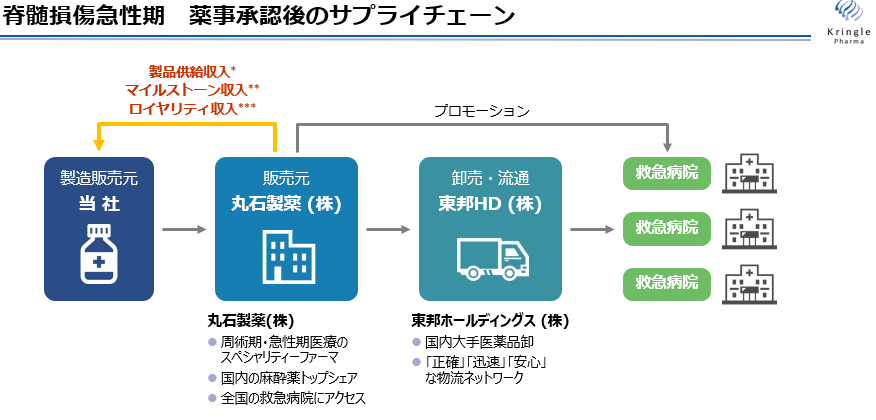
(同社資料より)
①-6 適応拡大
個々の難治性疾患は患者数が限られるが、複数パイプラインの開発を進めること、海外へ販売を拡大すること、他領域の疾患についても開発を進めることにより、市場の拡大が可能である。
*脊髄損傷急性期及びALS
HGFの神経保護作用が示された場合には、脳神経領域の疾患に対しても神経保護作用を示し、治療薬として開発される可能性が考えられる。
*声帯瘢痕
HGFの抗線維化作用が示されると、声帯以外の線維化が原因となる疾患への応用が考えられる。
*急性腎障害
HGFの効果が確認された場合には、腎臓以外の臓器における難治性疾患への応用の可能性が考えられる。
HGFは様々な作用を持っているため、一つの作用についての効果が確認されると、他領域への応用の可能性があると考えており、将来的には、同社において適応拡大による市場の拡大を行いながら他の製薬企業から他領域での開発を希望する提案を受けた場合には、原薬を供給することにより、継続的な収益を得ることも可能である。
②製造体制
組換えヒトHGFタンパク質を製品(医薬品)として製造するためには、細胞を安定的に増殖させ、HGFを高発現させる培養工程
と、不純物を取り除きHGFの純度を高める精製工程からなる「原薬製造」と、HGFを長期間安定化させる製剤組成により凍結乾燥を行う「製剤製造」の2つの製造が必要である。いずれも同社が実施権を保有しており、製造受託会社に委託して原薬及び製剤の製造を行っている。
「製剤製造」においては用途に応じた2つの製剤組成の特許を取得している。
製剤組成に関する特許(2022年1月31日現在)
|
特許の名称 |
概要 |
状況 |
|
HGF製剤 |
長期的な安定性を目的とした凍結乾燥製剤 |
日本、米国、欧州、カナダ、韓国にて特許取得済 |
|
神経疾患の治療に適したHGF製剤 |
長期的な安定性に加え、神経疾患の治療に適応できるよう組成を改良した凍結乾燥製剤 |
日本、米国、欧州、カナダ、韓国にて特許取得済 |
医薬品の製造については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(薬機法)及び「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令」(GMP省令)に基づき、厳格な品質管理の下で製造を行う必要がある。
また、組換えタンパク質を医薬品として製造する場合には細胞を用いた製造法となるため、複雑で特別な技術が多数必要である。
同社は、組換えヒトHGFタンパク質の製造方法(原薬製造及び製剤製造)のノウハウを有しており、製造受託会社2社に原薬製造及び製剤製造を各々委託することにより、製品の供給を行っている。
開発段階では、製品販売による収入が得られず、定期的な製造計画も決められないため、自社で製造設備を有して人材を確保・管理するよりも外部の受託機関を活用する方が経済的なリスクが低く、効率的と考えている。
また、難治性疾患を対象としているため、必要となる製品量も小スケールであることが想定され、開発から販売初期までは現在の製造体制を持続するが、適応症の追加や拡大等、開発状況に応じてスケールアップを検討することとしている。
さらに、現在米国においてドラッグマスターファイル(※)の登録を完了しており、提携会社が米国において組換えヒトHGFタンパク質の開発を行う場合には、クリングファーマの製造法を提携会社に開示することなく提携会社に原薬販売することが可能である。
※ドラッグマスターファイル
医薬品の原料、材料、あるいは原薬の製造関連情報をあらかじめ審査当局に登録しておく制度。最終製品を製造するメーカーに原料・材料の詳細情報を開示することなく治験申請や新薬承認申請を行うことができる。
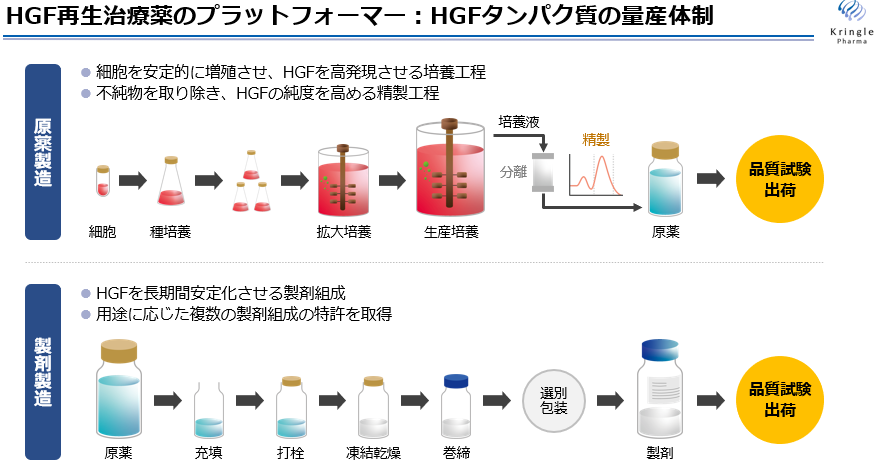
(同社資料より)
2.開発の状況
【2-1 概況】
臨床試験までステージが進んでいる自社パイプラインは4件(脊髄損傷急性期、声帯瘢痕、ALS、急性腎障害)。「原薬供給モデル」により米国クラリス社が臨床試験を実施しているパイプラインが1件(眼科疾患)ある。
このうち、第Ⅱ相以降のいわゆるレイトステージにあるのは、脊髄損傷急性期(第Ⅲ相実施中)、声帯瘢痕(第Ⅲ相実施中)、ALS(第Ⅱ相終了)、の3件。
現在はこの3疾患を対象とした医薬品開発に注力し、製造販売承認を得ることにリソースを集約している。
基礎研究については大学等との共同研究を継続し、新規適応症の開拓、新規シーズの探索を行っている。

(同社資料より)
【2-2 パイプライン】
(1)脊髄損傷急性期
(脊髄損傷概要)
脊髄とは脳と体をつなぐ神経が集積している組織であり、脊椎と呼ばれる骨の中に保護されている。
脊髄損傷とは、事故や転倒により脊髄に強い外力が加わり、組織が損傷を受けた結果、運動神経や感覚神経の機能が失われ、運動障害や感覚障害を発症する疾患。損傷部位が脳に近いほど広範な麻痺が見られる。
国内では年間約5千人、全世界では約6万人の新規患者が発生すると報告されている。
現時点では損傷した脊髄に対する有効な治療法はない。以前は炎症を抑制するためにステロイドが投与されていたが、ステロイドの大量投与は副作用も強いため、使われていない。脊髄を囲む脊椎の骨折や脱臼を治療するための手術や、リハビリテーションによる残存神経機能の有効利用と日常生活動作の獲得など、対症療法のみとなっている。長期入院可能なリハビリテーション施設が少ないこともあり、新規治療薬が実用化されれば患者及び介護者に対する大きな医療経済効果が見込まれる。
また、脊髄損傷治療には、同じく再生医療の細胞治療薬の開発が進められているが、細胞治療薬は、急性期ではなく、急性期後の亜急性期または慢性期に投与されることから待機時間が発生してしまうほか、受診機関も限定的で費用も高価である。
これに対し、HGFタンパク質は全国の救急病院で投与が可能であるほか、費用も比較的安価であり、有用性が高いと同社では考えている。
(HGFに期待される治療効果)
HGFは神経細胞に対し保護作用を示すこと、神経細胞から伸びた突起状の構造である軸索伸展の促進作用があることから、脊髄損傷の治療薬として期待が大きい。
脊髄損傷では外力によって引き起こされる組織の損傷(一次損傷)に続いて、周辺組織に損傷が広がる二次損傷が起こる。
脊髄損傷の急性期においては、二次損傷を抑えることが治療につながると考えられており、同社では慶應義塾大学医学部生理学及び整形外科との共同研究により、脊髄損傷モデル動物を用いて組換えヒトHGFタンパク質の薬理効果を確認する試験を実施したところ、運動機能評価において有効性が確認された。
そこで、医薬品の開発に必要な非臨床試験(毒性試験及び薬物動態試験など)を実施して、臨床試験に開発ステージを進めた。

(同社資料より)
(試験結果及び今後の計画)
◎第Ⅰ/Ⅱ相試験の結果
主要評価項目のうち、安全性に関する項目については問題ないことが確認できたが、有効性の指標としたASIA motor scoreの24週時(168日目)におけるベースラインからの変化量では有意な差が得られなかった。
しかしながら、経時的な推移ではプラセボ群に比較してHGF投与群において機能回復の傾向が一貫しており、副次評価項目であるASIA motor scoreの20週時(140日目)におけるベースラインからの変化量について有意差が認められたことから、HGFが神経細胞を保護して、運動機能を回復させる効果についてPOCが得られたと考えている。
第Ⅰ/Ⅱ相試験の結果を踏まえて、HGF(脊髄腔内投与用製剤:KP-100IT)は2019年9月に厚生労働省により脊髄損傷急性期を対象とした希少疾病用医薬品指定(オーファン指定※)を受けた。
また、試験の結果は、国際医学雑誌Journal of Neurotraumaにも論文発表されている。さらに、2021年6月には、アジア太平洋脊椎外科学会とアジア太平洋小児整形外科学会の第13回合同学会(APSSAPPOS2021)において、同試験に関する発表が APSS CONGRESS Best Clinical Research Award(APSS会議最優秀臨床研究賞)を受賞した。
※オーファン指定について
医薬品医療機器法 第77条の2に定められた希少疾病用医薬品指定制度。
以下の基準を満たした医薬品について厚生労働大臣が指定する。
指定されると、「開発費の助成を受けられる(上限50%、原則3年間)」「PMDAの優先審査を受けられる、相談申請手数料が減額される」「再審査期間の延長(10年間の市場独占期間が得られる)」といったメリットを享受できる。
指定基準
① 国内における対象者数が5万人未満であること。
② 医療上、特にその必要性が高いこと(治療法がない、または既存薬よりも著しく優れている)。
③ 開発の可能性が高いこと。
オーファン指定制度は海外にも存在するが、指定基準「③開発の可能性が高いこと」は日本独自の要件であり、臨床による安全性・有効性データが必要で、一段高いハードルが設定されている。
同社資料によれば、こうした高い基準をクリアしたオーファン指定品(2004年4月-2016年3月の間に指定された213品目)の約7割が上市(製造販売承認)されているということで、脊髄損傷急性期向けHGFの上市への期待も高まっている。
◎第III相試験を開始し、9割超の組入れを完了
この試験で得られたPOCを検証する目的で、2020年7月より第III相試験を開始した。
主要評価項目を「治験薬投与後6ヵ月のAISがC以上に改善した症例割合」とし、目標症例数は25症例。
2021年3月には市販後の治療体制を踏まえ治験実施施設を追加し、現在国内5施設で実施している。
治験者組入れを進めてきたが、新型コロナウイルス感染症の感染再拡大と長期化の影響を受け、患者組入れが計画通りに進まず、治験期間を6か月延長した。このため当初は2022年後半に組入れ終了予定であったが、やや遅延したものの2023年1月には目標症例数の9割超の組入れを完了した。今後も治験実施医療機関と緊密に連携し、2023年前半に患者組入れ完了を目指す。
最終組入れ完了後、約6か月経過した2023年後半に最終症例の経過観察が終了し、その後に総括報告書が発行される予定である。有効性を示すデータが得られた場合には製造販売承認申請を進める考えだ。
(2)声帯瘢痕
(声帯瘢痕概要)
声帯の物性が固く変化(線維化、瘢痕化)して動きが悪くなるため、声が出しにくくなる音声障害を生じる疾患。
発症原因は明らかになっていないが、声帯の外傷や炎症、声帯の手術後などに起こりやすい。
患者数は国内に3,000~12,000人と推定される。
これまでのところ、声帯瘢痕に対する有効な治療法はなく、音声訓練等のリハビリテーション及び声帯の位置を移動する手術といった対症療法が中心である。
(HGFに期待される治療効果)
HGFの生物活性として線維化を抑制する抗線維化作用があるため、声帯瘢痕の治療にも活用できる可能性があると考えられる。
同社では、京都大学医学部耳鼻咽喉科・頭頸部外科及び公益財団法人先端医療振興財団(現 公益財団法人神戸医療産業都市推進機構)との共同研究により、声帯瘢痕モデル動物の声帯内に組換えヒトHGFタンパク質を投与したところ、声帯機能の改善を認めた。そこで、医薬品の開発に必要な非臨床試験(声帯内投与における試験)を追加で実施し、臨床試験に開発ステージを進めた。
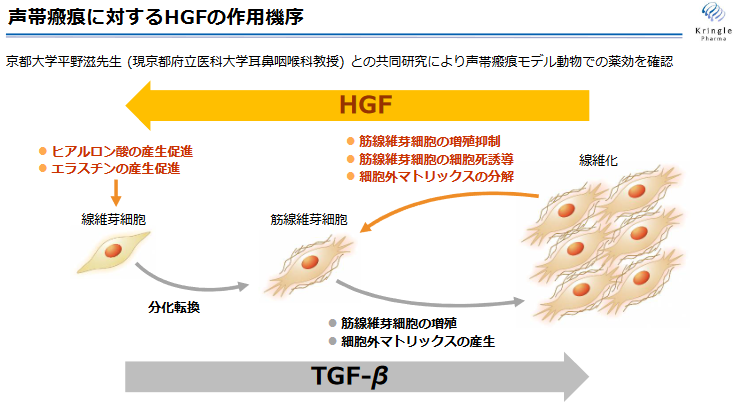
(同社資料より)
(試験結果及び今後の計画)
◎第I/II相試験の結果
声帯瘢痕患者を対象とした第I/II相試験の主要評価項目である安全性の確認について、重篤な副作用は認められず、忍容性も良好であることが示された。また、副次評価項目において、効果の改善傾向が見られる評価項目、評価時期についての知見が得られた。
◎第Ⅲ相試験を開始
これらの結果を基に、第Ⅲ相試験の計画を策定し2022年10月に治験計画届を独立行政法人医薬品医療機器総合機構(PMDA)に提出し受理された。その後、PMDA による治験計画届の調査期間が終了し、2022年11月、京都府立医科大学附属病院において治験を開始した。
治験デザインは多施設共同ランダム化試験。目標症例数は62症例。主要評価項目は二重盲検期の観察期間24週目におけるVHI-10(※)スコア改善率としている。
第Ⅲ相試験は京都府立医科大学附属病院を含む国内5施設において実施する予定で、各施設では契約等の準備が完了次第、順次症例組入れを開始する。
2023年1月に、第一例目の症例が登録された。
2024年後半の組入れ終了、2025年後半の最終症例の経過観察終了、その後の総括報告書発行を予定している。
※VHI-10(Voice Handicap Index-10)
10項目の質問から、自分の声をハンディキャップと感じている程度を患者本人がスコア化する。各質問は、 0(障害なし)から4(最大障害)までの回答が設定されており、症状が悪化するほど高値となる。
◎治験薬の製造と市販製剤の開発にも着手
試験進行と同時に、承認後の市販を見据え、声帯瘢痕用治験薬の製造と市販製剤の開発にも着手している。
市販用の少量製剤を検討しているほか、市販スケールでの製造検討及び各種試験を実施する。
声帯瘢痕に対する投与用量は神経系の疾患と比較して10分の1以下であり、声帯瘢痕の臨床試験では、脊髄損傷急性期及びALSの臨床試験に使用されている製剤と同じものを希釈して使用するものの、市販に向けては声帯瘢痕用の少量製剤が必要になるためである。
◎線維化が原因となる慢性疾患への適応拡大の可能性
声帯瘢痕においてHGFの効果が確認された場合には、HGFの「抗線維化」作用に基づく創薬コンセプトそのものが示されることになり、声帯瘢痕のみならず他の線維化が原因となる慢性疾患(慢性腎不全、肝硬変、肺線維症等)への適応拡大の可能性が示されると考えている。
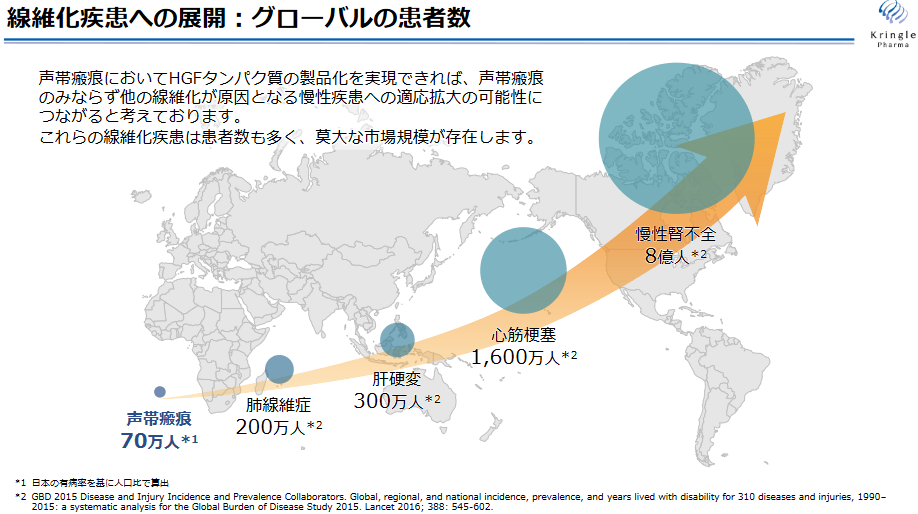
(同社資料より)
(3)ALS(筋萎縮性側索硬化症)
(ALS概要)
ALSは「難病の患者に対する医療等に関する法律」において難病指定を受けている難治性神経疾患の1つ。1920-1930年代に活躍したアメリカのプロ野球選手ルー・ゲーリックが罹患したことからルー・ゲーリック病とも呼ばれている
運動神経細胞が選択的に障害を受けるため、筋力の低下、筋肉の萎縮が引き起こされ、その結果、歩行困難、言語障害、嚥下障害及び呼吸障害等の症状が進行的に現れ、発症後3~5年で約80%の患者が死亡すると言われている。
患者数は国内約1万人、全世界で約9万人と言われている。
すでに承認された医薬品が2剤あるが、いずれも効果は限定的。リハビリテーションによる生活動作の維持・獲得、鎮痛剤を用いた痛みの抑制などの対症療法が既存治療法となっており、脊髄損傷と同様に、新規治療薬が実用化されれば患者及び介護者に対する大きな医療経済効果が見込まれる。
(HGFに期待される治療効果)
ALSの発症要因は遺伝によるもの、グルタミン酸毒性によるもの、原因不明のものと様々だが、運動神経細胞が障害を受け脱落することにより筋肉の萎縮が起こることが共通する現象であるため、運動神経細胞を保護することが治療効果につながると考えられる。したがって、脊髄損傷同様に、HGFの神経細胞に対する保護作用、軸索伸展の促進作用はALSの治療につながると同社では考えている。
同社は、東北大学医学部脳神経内科との共同研究により、ALSモデル動物を用いて組換えヒトHGFタンパク質の薬理効果を確認する試験を実施したところ、運動機能の回復、発症の遅延、生存期間の延長といった効果を確認した。
そこで、医薬品の開発に必要な非臨床試験(毒性試験及び薬物動態試験など)を実施して、臨床試験に開発ステージを進めた。
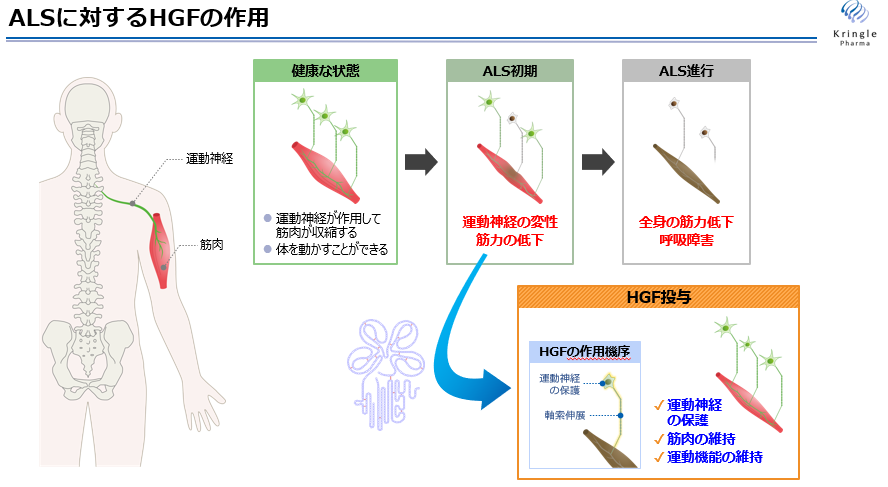
(同社資料より)
(試験結果及び今後の計画)
◎第Ⅰ相試験の結果
第Ⅰ相試験の主要評価項目である安全性及び忍容性の確認について、重篤な副作用は認められず、良好であることが示された。また、副次評価項目として、適切な投与量を策定するために薬物動態を検討した結果、有効性を検討するために必要な投与量についての知見が得られた。
◎第II相試験を実施中
第Ⅰ相試験で得られた結果を基に、2016年5月よりPOCの確認を目的とした第II相試験を実施している。
主要評価項目を「二重盲検期24週のALSFRS-Rスコア変化量の群間差」とした第II相試験(目標症例数は48症例)は、医師主導治験であるため、同社は治験薬提供者として携わり、試験終了後の事業化に関しては同社が独占的に行う契約となっている。
国内2施設(東北大学病院、大阪大学医学部附属病院)での治験において、症例の組入れは2020年11月に終了し、最終症例の最終観察も2021年12月に終了している。
22年8月に、東北大学から解析結果についての報告(速報)があり、以下のような内容であった。
*主要評価項目に関して統計的有意差はなかった。
*事前に定めた副次評価項目に関して統計的有意差はなかった。
*HGFタンパク質製剤投与群において進行抑制が認められた症例もあり、本試験結果の解釈にはさらに詳細な解析が必要。
*安全性に関しては、HGFタンパク質製剤とプラセボ群で有害事象の発現率は同程度であり、忍容性が確認された。
追加解析を実施するとともに、今後の開発の方向性については、東北大学によるさらなる詳細な解析結果を踏まえ、東北大学と協議の上、決定する。
ALSは、世界的な注目も高まり海外企業も治療薬開発に積極的に取り組んでいるが、大きな成果は未だ見られない。同社の第II相試験で良好な結果が得られれば、グローバルベースでの提携の道が大きく開かれる可能性もある。
(4)急性腎障害
(急性腎障害概要)
腎臓の損傷、腎臓への血液供給不足、尿路の閉塞等により、数時間~数日という短い期間に急激に腎機能が低下し、その結果、尿を介した老廃物の排泄ができなくなり、体内の水分や塩分量などを調節することができなくなる疾患。重篤な場合には救急医療が必要になり、死亡に至る場合もある。
発症要因が多数あるため、原因を特定できない場合が多く、有効な治療法は確立されていない。
(HGFに期待される治療効果)
HGFは腎臓の細胞に対して保護効果や増殖作用を示すことから、急性腎障害の治療薬となる可能性があると考えられる。
同社は、米国の腎臓専門クリニック「Rogosin Institute」の協力を得て米国において臨床試験を行った。ただし、第I相試験においては、組換えヒトHGFタンパク質の安全性を確認することが目的であるため、容態の不安定な急性腎障害患者を対象とすることは不適切であると判断し、比較的容態が安定している慢性腎不全患者を対象として試験を実施した。
(試験結果及び今後の計画)
◎臨床試験の計画を策定中
同試験は、米国食品医薬品局(FDA)により、必要性の高い新薬の審査を優先的に行う制度である「Fast Track」の認定を受けて実施しているが、主要評価項目である安全性及び忍容性については、重篤な副作用及び死亡例はなく、安全性が確認された。
同試験において得られた情報を基に、次相試験として急性腎障害患者を対象とした臨床試験の計画を策定している。また、国内での臨床試験実施を想定した第I相試験の追加試験(日本人での最大耐用量を確認する小規模試験)についても同時に策定中。
具体的には、急性腎障害を対象とした治験実施計画書の作成のため、医学専門家へのヒアリング、他社治験例の検討、バイオマーカー調査等の検討を行っている。
ただ、次相試験は比較的大規模なプラセボ対照二重盲検比較試験になることが想定されており、現状では同社単独で神経系の治験と並行しての開発継続は難しいと判断し、製薬企業等と提携し、開発資金を確保した上で開発を進める方針である。
また現在、欧米において急性腎障害を対象とする競合品が第III相試験の開発段階にあることから、その動向を注視しつつ、HGFの優位性を示すための開発を進めていく考えである。
なお、静脈内投与は最も全身性に被験薬が到達するため、安全性の問題も発生しやすい投与経路であるが、同試験において安全性が確認されたことで、他の投与経路の開発を進める上で重要な知見が得られたと考えている。静脈内投与は様々な疾患に適応拡大しやすい投与経路であることから、急性腎障害に限らず、安全性及び有効性が効果的に確認できる疾患を策定しながら開発を進める方針である。
⑤その他のパイプライン
前述のように、同社はクラリス社が行っている眼科領域での治療薬開発のために組換えヒトHGFタンパク質を供給している。
クラリス社は、眼科疾患動物モデルでのHGFの治療効果を確認した米国ハーバード大学のグループが設立したバイオベンチャー。クラリス社からクリングルファーマにコンタクトがあり、2020年4月に原薬供給契約を締結。クリングルファーマはクラリス社に対し、眼科領域に限定して組換えヒトHGFタンパク質を有効成分とした医薬品の開発、製造、販売、輸出入等を全世界で行うための独占的実施権を許諾した。
2021年5月にクラリス社は米国において眼科疾患(※神経栄養性角膜炎)を対象とする第Ⅰ/Ⅱ相試験を開始するための新薬治験開始を申請し、同年8月には第一例目の被験者への投与が行われた。
2022年7月には、カナダにおいても第Ⅰ/Ⅱ相試験を開始するために Health Canada(カナダ保健省)に治験申請を行い、承認された。
米国での組み入れ開始を起点としてクリングルファーマは毎年定額の技術アクセスフィーをクラリス社より受領しており、カナダにおける第Ⅰ/Ⅱ相試験の開始により、症例組入れの更なる加速が期待される。
また、クリングルファーマは、クラリス社の開発品目に関する日本におけるライセンス契約の優先交渉権を保有しており、クラリス社の眼科領域における開発進展はクリングルファーマにとって大きな価値を生み出すこととなる。
※神経栄養性角膜炎
角膜の変性疾患で、角膜の知覚が低下することにより、角膜上皮の障害、角膜潰瘍、角膜穿孔などを引き起こす難治性の疾患。罹患率は人口あたり 0.04%と、極めて稀な疾患だが、重症になると視機能の低下、失明に至ることもある。角膜知覚の低下は角膜のウイルス感染、外傷、角膜手術や、糖尿病などの全身症状が原因となり、角膜疾患の中でも極めて疾病管理が難しいとされている。
クリングルファーマは、この他、国内外の大学や企業との共同研究において基礎研究を行い、新規パイプラインの強化を進めている。クラリス社のケース同様に、原薬あるいは治験薬の提供を行い、共同研究先で有望なデータが得られた場合には成果を共有し、開発ステージを進める予定である。
3.成長戦略
(1)概要
現在、5つの対象疾患でHGFタンパク質の治験を推進している。このうち当面は、レイトステージのパイプラインである脊髄損傷急性期、声帯瘢痕、ALSの3疾患を対象とした医薬品開発に注力し、薬事承認を得ることにリソースを集約する。
最も開発が進んでいる国内の脊髄損傷急性期は2023年前半に第Ⅲ相試験の患者組入れ完了、2023 年後半に最終症例の経過観察終了を見込んでおり、2025年9月期以降は、恒常的な製品売上により黒字化達成を目指す考えだ。
声帯瘢痕は2022年11月に第Ⅲ相試験が開始された。
脊髄損傷急性期、ALS、急性腎障害においては、提携パートナーとともに海外での開発にも取り組んでいく(ALSは国内も提携パートナーによる開発)。
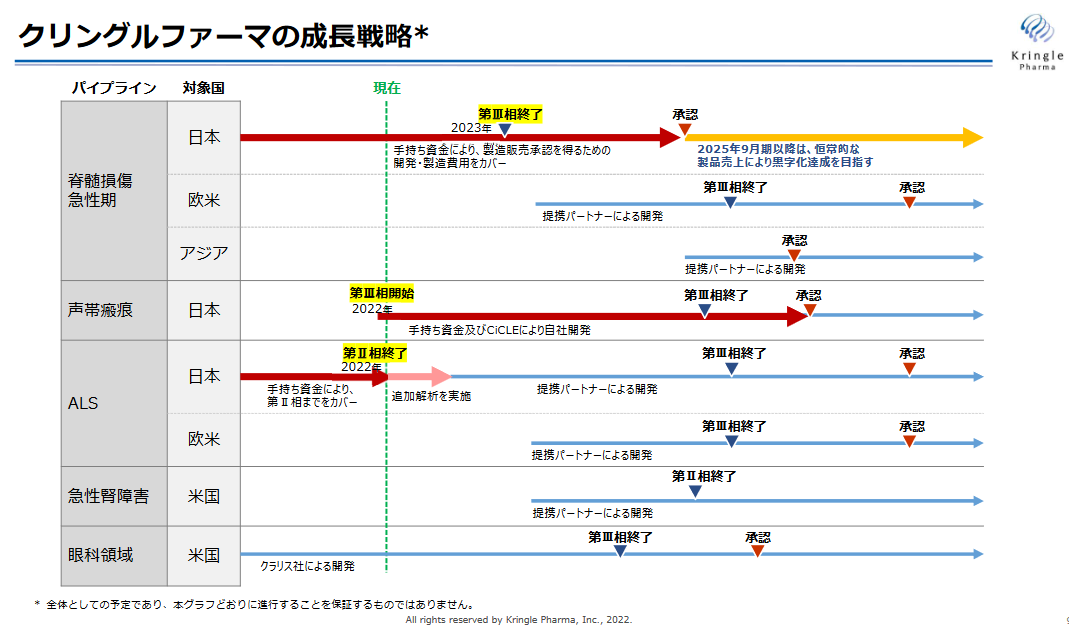
(同社資料より)
(2)適応拡大の可能性を追求
同社では、HGFタンパク質製剤(KP-100IT)の市場規模を最大で、脊髄損傷急性期「国内100億円、海外500億円」、ALS「国内200億円、海外1,000億円」、声帯瘢痕「国内50億円、海外300億円」と推定しているが、前述のように、例えば声帯瘢痕が分類される「線維化疾患」は、肝硬変、慢性腎不全、心筋梗塞など患者数が極めて多い疾患である。
またその他、認知症、脳梗塞、のほか、糖尿病性腎症、血管障害、喘息などの難治性疾患への適応拡大の可能性も高く、その範囲は極めて広いため、グローバルな巨大市場へのアクセスも可能となる。
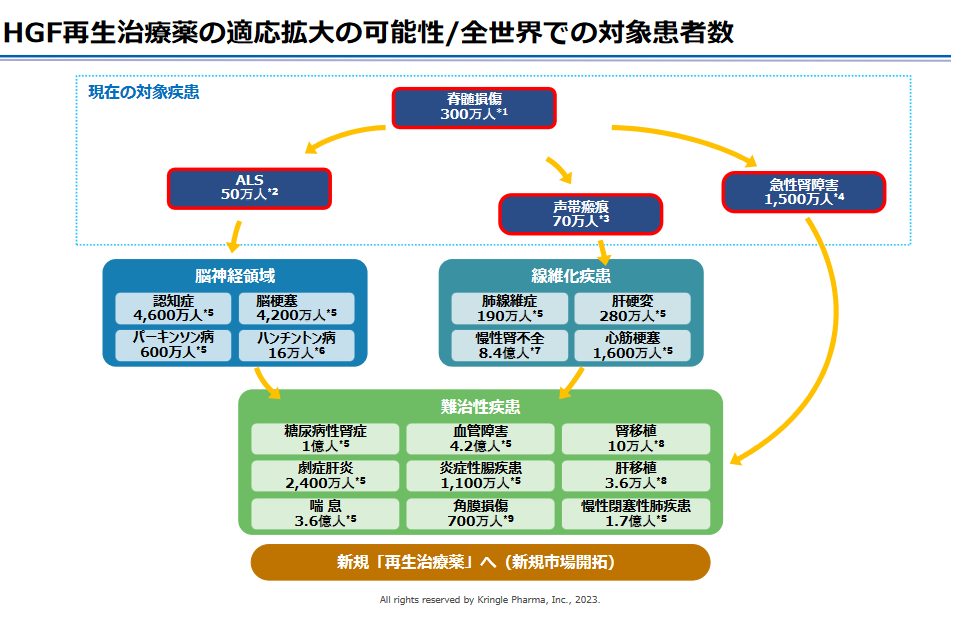
(同社資料より)
(3)新規「再生治療薬」による新規市場開拓
アカデミアとの共同研究を通じた新規再生治療薬による新規市場開拓にも積極的に取り組んでいる。
◎慶應義塾大学 岡野栄之教授・中村雅也教授との共同研究
22年3月、学校法人慶應義塾と共同で慢性期脊髄損傷に対する治療に関する特許出願を行った。また、22年9月には、同大学と共同で、急性期及び亜急性期脊髄損傷に対する次世代複合治療法に関する特許出願を行った。
(特許出願の背景)
脊髄損傷急性期患者を対象に組換えヒト HGF タンパク質(HGF)を投与する第III相臨床試験を実施すると共に、慶應義塾大学医学部生理学教室 岡野栄之教授及び同大学医学部整形外科学教室 中村雅也教授と新規の脊髄損傷治療に関する共同研究を進めてきた。
その研究において、慢性期完全脊髄損傷モデル動物に対して、慶應義塾大学が保有する iPS 細胞由来神経幹/前駆細胞と同社が開発する HGF 及びスキャフォールド(足場基材)を併用することにより、脊髄の神経線維を切断した完全脊髄損傷モデル動物の慢性期において、新たな神経回路の構築による運動機能と排尿機能の回復に世界で初めて成功した。この研究成果に基づき、22年3月に共同で特許出願を行った。
さらに、重度の脊髄損傷モデル動物に対して、急性期にHGFを投与することに加え、亜急性期にiPS細胞由来神経幹/前 駆細胞を移植したところ、各単独投与群に比べ顕著な運動機能の回復がみられたことから、22年9月に本共同研究に基づく2件目の特許共同出願を行った。
(複合治療研究成果に関する論文の掲載)
2023年1月、慢性期完全脊髄損傷に対する複合治療に関する共同研究の成果が、国際学術雑誌「Biomaterials(バイオマテリアルズ)」のオンライン版に論文掲載された。
今回、論文として掲載された研究成果は、これまで最も回復が困難であると考えられていた慢性期の完全脊髄損傷に対する革新的な治療法の確立につながる重要な一歩となり、脊髄損傷を受傷してから時間が経過しても、運動機能の回復を見込める可能性が広がることとなる。
(今後の展開)
脊髄損傷慢性期患者の多くはリハビリテーションを行っても回復は望みがたいケースがほとんどとのことである。
また、脊髄損傷慢性期患者数は、日本で10-20万人、全世界で110万人と同社は推計しており、現在臨床試験中の脊髄損傷急性期患者数(日本 年間5000人、全世界同6万人)と比較すると格段に社会的意義、市場性とも大きい。
急性期の後は、慢性期まで対象を広げる考えで、有効な治療方法が確立されていない脊髄損傷に対し、中長期的な観点でその解決に取り組んでいく。
また、急性期及び亜急性期の脊髄損傷に対する次世代複合治療法に関しては、HGF及びiPS細胞由来神経幹/前駆細胞の単独治療が既にヒトでの臨床段階に進んでいることから、両者の併用治療は早期に実用化されることが期待される。
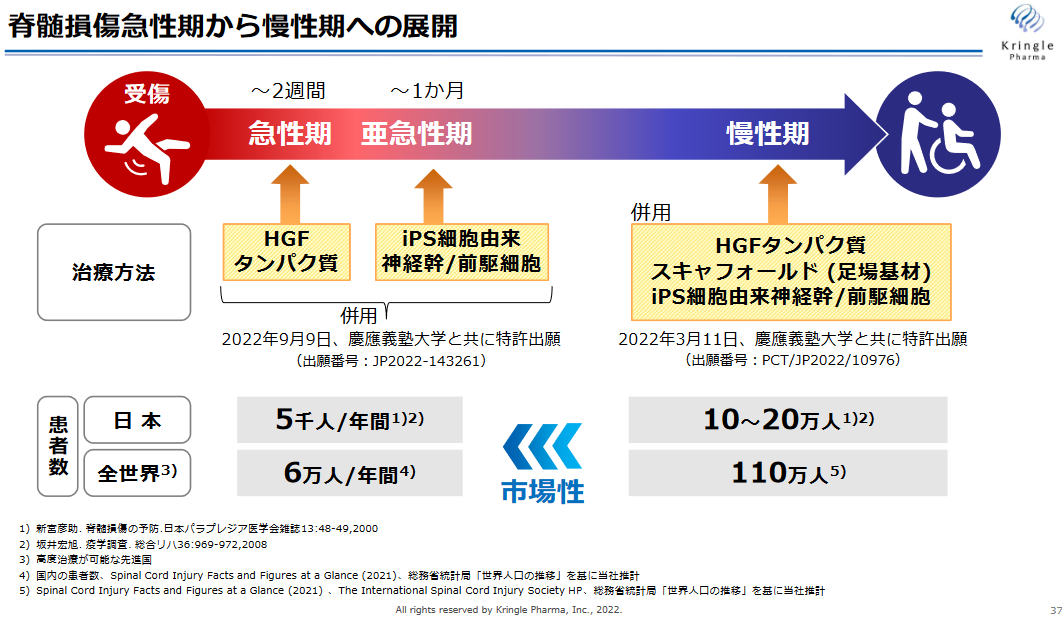
(同社資料より)
◎東京医科歯科大学 岡本隆一教授との共同研究
国立大学法人東京医科歯科大学が実施する自家腸上皮幹細胞移植による再生医療の臨床研究に関し、2018年10月より同大学と共同研究を実施している。
2022年7月、同大学より、潰瘍性大腸炎の難治性潰瘍の修復を目指した自家腸上皮オルガノイド(※)移植による臨床研究において、第1例目が実施された。
(研究の概要)
この研究は、東京医科歯科大学大学院医歯学総合研究科消化器病態学分野の岡本隆一教授、同大学学術顧問・副学長で高等研究院の渡辺守特別栄誉教授らのグループが推進している再生医療研究である。
難治性潰瘍性大腸炎の患者に対し、患者自身から採取した少量の組織から樹立した腸上皮幹細胞を含むオルガノイドを移植し、傷んだ腸の粘膜上皮の修復再生を目指すもので、この臨床研究では安全性と効果の検討を目的としている。
この研究はオルガノイドを移植する画期的な再生医療研究であり、難治性の潰瘍性大腸炎の患者に対して組織再生を促す新たな治療法となることが期待されている。
同社が供給している医薬品グレードの組換え HGF タンパク質は、移植治療に用いる腸上皮オルガノイドを作製する際に他の因子と共に使用されており、マルチな作用を持つHGFは、再生医療研究においてさまざまな使用方法が検討されている。
同研究は、組換えHGFタンパク質そのものをヒトに投与するものではないが、再生医療におけるHGFの新たな付加価値を生み出している。
※オルガノイド
「ミニ臓器」とも呼ばれ、体外で3次元構造を持ちあたかも小さな臓器のような構造と機能を備えた細胞の集合体。腸上皮オルガノイドは腸上皮幹細胞を含み、適切な環境と操作の下で大量・長期に増やすことが可能。
(4)「ハイブリッドビジネスモデル」「適応拡大」「海外市場開拓」による成長
このように、神経系の開発パイプライン(脊髄損傷急性期及びALS)に加え、線維化疾患の開発パイプラインとして声帯瘢痕の開発を推進し、自社開発による早期販売と利益の最大化を目指しながら、ビジネスモデル「B」「C」を適切に組み合わせ、「適応拡大」「海外市場開拓」によって中長期の売上・利益の成長を目指していくのが、クリングルファーマの成長戦略である。
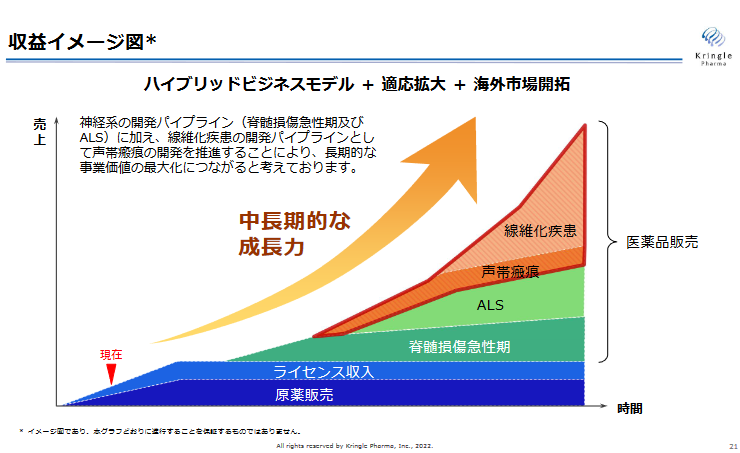
(同社資料より)
4.業績動向
【4-1 23年9月期第1四半期業績概要】
|
22/9期1Q |
23/9期1Q |
増減額 |
増減率 |
|
|
売上高 |
13 |
17 |
3 |
+25.8% |
|
売上総利益 |
13 |
17 |
3 |
+25.8% |
|
販管費 |
133 |
174 |
40 |
+30.5% |
|
うち研究開発費 |
82 |
119 |
37 |
+45.1% |
|
営業利益 |
-120 |
-157 |
-37 |
– |
|
経常利益 |
-128 |
-157 |
-28 |
– |
|
四半期純利益 |
-129 |
-157 |
-28 |
– |
*単位:百万円
売上高は前年同期比25.8%増の17百万円。内容は、クラリス社からの技術アクセスフィー。
研究開発費は同45.1%増の1億19百万円。内容は、脊髄損傷の治験費用、声帯瘢痕の治験準備費用、HGF製造開発に係る各種試験費用など。
【4-2 財務状態】
◎主要BS
|
22年9月末 |
22年12月末 |
増減 |
22年9月末 |
22年12月末 |
増減 |
||
|
流動資産 |
3,207 |
3,047 |
-160 |
負債合計 |
419 |
415 |
-4 |
|
現預金 |
2,756 |
2,591 |
-164 |
純資産 |
2,789 |
2,632 |
-156 |
|
固定資産 |
1 |
1 |
0 |
利益剰余金 |
-331 |
-489 |
-157 |
|
資産合計 |
3,208 |
3,048 |
-160 |
負債純資産合計 |
3,208 |
3,048 |
-160 |
*単位:百万円
現預金の減少などで資産合計は前期末比1億60百万円減少の30億48百万円。
自己資本比率は前期末比0.6ポイント低下の86.2%。
【4-3 トピックス】
(1)脊髄損傷急性期に対する第III相臨床試験で目標症例数の9割超を組入れ完了
2023年1月、脊髄損傷急性期に対する第III相臨床試験で目標症例数の9割超の組入れを完了したと発表した。今後も治験実施医療機関と緊密に連携し、早期の患者組入れ完了を目指す。
詳細は、「2.開発の概況」を参照。
(2)声帯瘢痕に対する第III相臨床試験で第一例目の症例を登録
2023年1月、声帯瘢痕に対する第III相臨床試験において第一例目の症例を登録した。
詳細は、「2.開発の概況」を参照。
(3)慢性期完全脊髄損傷に対する複合治療研究成果の論文掲載
2023年1月、慢性期完全脊髄損傷に対する複合治療に関する共同研究の成果が、国際学術雑誌「Biomaterials(バイオマテリアルズ)」のオンライン版に論文掲載された。
詳細は、「3.成長戦略」を参照。
【4-4 業績予想】
|
22/9期 |
23/9期(予) |
増減額 |
増減率 |
|
|
売上高 |
391 |
68 |
-323 |
-82.6% |
|
売上総利益 |
303 |
68 |
-235 |
-77.6% |
|
販管費 |
729 |
1,062 |
+332 |
+45.6% |
|
うち研究開発費 |
533 |
833 |
+300 |
+56.3% |
|
営業利益 |
-426 |
-993 |
-567 |
– |
|
経常利益 |
-330 |
-953 |
-623 |
– |
|
当期純利益 |
-331 |
-955 |
-623 |
– |
*単位:百万円。
売上高は前期比3億23百万円減の68百万円。現時点ではクラリス社へのHGF原薬供給は発生せず、技術アクセスフィーのみを計上している。
研究開発費は同3億円増の8億33百万円。内訳は、脊髄損傷の薬事申請準備費用の増加、声帯瘢痕の開発費用の増加、HGF製造開発に係る各種試験費用の増加など。
研究開発費の内訳は以下の通り。前期比3億円の増加の中心は、脊髄損傷の薬事申請準備費用、声帯瘢痕についての第Ⅲ相試験の実施費用および治験薬製造及び市販製剤の開発費、脊髄損傷の商品化に向けた製剤開発等の各種試験費用など。臨床試験実施に加え、上市後を見据えた開発投資にも積極的である。
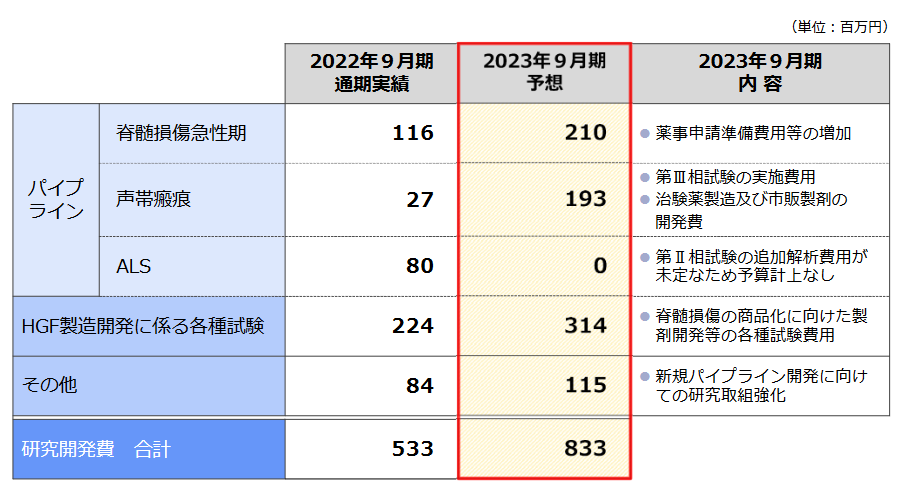
(同社資料より)
5.今後の注目点
23年1月に、脊髄損傷急性期に対する第III相臨床試験で目標症例数の9割超の組入れを完了したほか、声帯瘢痕に対する第III相臨床試験で第一例目の症例を登録するなど、開発は着実に進展していることが確認できた。
引き続き、「脊髄損傷急性期の組入れ終了→約半年後の2023年中の最終症例の経過観察終了→統括報告書発行」の順調な進展に期待したい。
<参考:コーポレート・ガバナンスについて>
◎組織形態、取締役、監査役の構成
|
組織形態 |
監査役設置会社 |
|
取締役 |
7名、うち社外2名 |
|
監査役 |
3名、うち社外3名 |
◎コーポレート・ガバナンス報告書
最終更新日:2022年12月23日
<基本的な考え方>
当社は「株主」、「社員」、「社会」、「病院等のお客様」、「患者」、「協力会社」という全てのステークホルダーから「価値ある企業」として支持され続けるために、企業価値・株主価値の 最大化に努めるとともに、意思決定の迅速化、経営の透明性・公正性を高めていく必要があると考えております。そのために、内部統制システムの整備に注力するとともに、法令・定款の遵守、リスク管理強化、適時かつ公平な情報開示の徹底など、コーポレート・ガバナンスの充実・向上を経営上の重要な課題であると認識し、コーポレート・ガバナンス(企業統治)の強化に努めております。
<コーポレートガバナンス・コードの各原則を実施しない理由>
当社は、コーポレートガバナンス・コードの基本原則をすべて実施しております。

