ソレイジア・ファーマ(4597) arfolitixorin実用化の道筋に着目
|
 荒井 好裕 社長 |
ソレイジア・ファーマ株式会社(4597) |
|
 |
企業情報
|
市場 |
東証グロース市場 |
|
業種 |
医薬品(製造業) |
|
代表取締役社長 |
荒井 好裕 |
|
所在地 |
東京都港区芝公園2-11-1 住友不動産芝公園タワー4F |
|
決算月 |
12月末日 |
|
HP |
株式情報
|
株価 |
発行済株式数(期末) |
時価総額 |
ROE(実) |
売買単位 |
|
|
56円 |
150,092,310株 |
8,405百万円 |
-79.4% |
100株 |
|
|
DPS(予) |
配当利回り(予) |
EPS(予) |
PER(予) |
BPS(実) |
PBR(倍) |
|
0.00円 |
– |
-8.02円 |
– |
17.31円 |
3.2倍 |
*株価は9/20終値。発行済株式数、DPS、EPS、BPSは22年12月期第2四半期決算短信より。EPSは予想の下限。ROEは前期実績。
業績推移
|
決算期 |
売上高 |
営業利益 |
税引前利益 |
当期利益 |
EPS |
DPS |
|
2018年12月(実) |
318 |
-2,420 |
-2,445 |
-2,422 |
-25.98 |
0.00 |
|
2019年12月(実) |
1,310 |
-1,762 |
-1,797 |
-1,867 |
-17.75 |
0.00 |
|
2020年12月(実) |
454 |
-4,116 |
-4,159 |
-4,127 |
-35.16 |
0.00 |
|
2021年12月(実) |
559 |
-2,419 |
-2,442 |
-2,478 |
-19.04 |
0.00 |
|
2022年12月(予) |
2,300 ~3,800 |
-1,100 ~150 |
-1,100 ~150 |
-1,200 ~50 |
-8.02 ~0.33 |
0.00 |
*予想は会社側予想。IFRS適用。当期利益は親会社の所有者に帰属する当期利益。以下同様。
ソレイジア・ファーマの2022年12月期第2四半期決算概要などをご紹介します。
目次
今回のポイント
1.会社概要
2.2022年12月期第2四半期決算概要
3.2022年12月期業績予想と今後の目標
4.今後の注目点
<参考:コーポレートガバナンスについて>
今回のポイント
- 22年12月期第2四半期の売上収益は前年同期比88百万円減の1億89百万円。内訳は主に「Sancuso® (SP-01)」および「エピシル® (SP-03)」の製品販売収益。研究開発費は、同2億69百万円減の3億47百万円。主に、「ダルビアス® (SP-02)」の製造販売承認に関する費用、「arfolitixorin(SP-05)」の第III相臨床試験(最終試験)の臨床開発投資。販管費は、同1億42百万円増の10億8百万円。中国自販体制解消関連一時費用の一部発生で増加した。販管費のうち償却費は2億19百万円。「Sancuso® (SP-01)」および「エピシル® (SP-03)」の無形資産償却費用等。これらの結果、営業損失は同1億33百万円縮小し12億28百万円となった。
- 22年12月期業績予想に変更はない。売上収益は23~38億円、営業利益は損失11億円から利益1.5億円のレンジを予想。「Sancuso® (SP-01)」及び「エピシル® (SP-03)」の販売収益に加え、「ダルビアス® (SP-02)」の販売収益及び海外権利導出契約収入、「arfolitixorin(SP-05)」の日本権利導出収入を見込んでいる。
- 当初想定通り「ダルビアス® (SP-02)」の製造販売承認を取得し、8月に販売を開始した。また日本化薬との資本業務提携を締結し、約10億円の資金調達を行った。開発・販売における有力なパートナーを獲得することができたと考えている。
- 一方、コロナ禍による中国におけるロックダウンの影響は大きく、想定通りの売上が見込めない中、コスト削減が必要との判断から、中国3都市(北京市、上海市、広州市)における自販体制を解消した。3都市における販売権を、これまで3都市以外の販売を担っていたLee’s Pharmaceutical (HK) Limitedに移管した。中国全土の市場に提供される「Sancuso® (SP-01)」及び「エピシル® (SP-03)」は、今後ソレイジア・ファーマが Lees社 に供給する。
- 22年8月、「arfolitixorin (SP-05)」の第Ⅲ相臨床試験のトップライン速報結果が公表されたが、残念ながら、グローバルデータでの ORR(全奏効率:主要評価項目)及びPFS(無憎悪生存期間:副次評価項目)につき、arfolitixorin 併用群は標準療法群に対して統計学的に有意な改善を示さなかったと公表された。
- ただ、同社では「arfolitixorin (SP-05)」実用化の道筋は十分あると考えている。今後は、対象を日本人患者に絞ったサブグループ解析、更新PFS解析、OS解析(全生存期間)等の追加解析の結果をIsofol社と共同で見極めていくが、例えば日本人での解析結果が速めに明らかになりポジティブであれば今期中若しくは来期前半の導出契約成立、金契約金収受の可能性もあるとのことで、追加解析の結果を待ちたい。また、予定通り3番目の製品実用化となった「ダルビアス® (SP-02)」の販売状況、海外における導出についても進捗を注目していきたい。
1.会社概要
がん領域に特化したスペシャリティ・ファーマ(※)として、有望市場である日本、中国を中心としたアジア地域においてがん治療薬、がんサポーティブケア(がん支持療法医薬品等)などの開発及び販売を行う。
荒井社長率いる実務経験豊富な開発スタッフ、開発成功確率の高さ、安定した事業基盤、事業の早期実現可能性などが大きな強み・特長。
(※)スペシャリティ・ファーマ:得意分野において国際的にも一定の評価を得る研究開発力を有する新薬開発企業のこと。
【1-1 沿革】
2006年12月に伊藤忠商事とバイオビジネスに特化した米国のVCであるMPMキャピタルが共同で医薬品開発事業の準備拠点として米国に設立したJapan Bridge Inc.が前身。
2008年5月に第1号開発品「Sancuso®(SP-01)」の日本、台湾、シンガポール、マレーシア、中国(香港、マカオ含む)での独占的開発販売権を導入。
2008年9月、ソレイジア・ファーマ株式会社に商号を変更した。
その後、「ダルビアス®(SP-02)」のアジア太平洋地域の独占的開発販売権導入(2011年3月)、米国、欧州諸国を含めた全世界での独占的開発販売権導入(2014年7月)、「エピシル® (SP-03)」の日本、中国での独占的開発販売権導入(2015年3月)などパイプラインの拡充を進めるとともに、「Sancuso®(SP-01)」の台湾、香港等での独占的開発販売権を協和キリン株式会社に導出(2010年2月)、「Sancuso®(SP-01)」の中国(「北京、上海、広州、香港、マカオを除く」契約締結時)での独占的販売権をLee's Pharmaceutical (HK) Limitedに導出など、収益化への道筋も構築していく。
2016年には「エピシル® (SP-03)」について、中国・日本両国において医療機器製造販売承認を申請するとともに、日本での独占的販売権をMeiji Seika ファルマ株式会社に、中国(「北京、上海、広州を除く」契約締結時)での独占的販売権をLee’s Pharmaceutical (HK) Limitedに導出。
がん領域に特化したスペシャリティ・ファーマとしての成長性を期待され、2017年3月に東京証券取引所マザーズに上場した。
2017年11月、「PledOx®(SP-04)」の日本、中国、韓国、台湾、香港及びマカオでの独占的開発販売権を導入、2020年8月には「arfolitixorin(SP-05)」の日本における独占的開発販売権を導入し、パイプラインは現在5品目。
2018年5月には「エピシル®(SP-03)」の国内販売が始まり、同社製品初の上市となった。次いで2019年に中国において「Sancuso®(SP-01)」、「エピシル®(SP-03)」、2020年には韓国において「エピシル®(SP-03)」が、2022年8月には日本において「ダルビアス®(SP-02)」が販売を開始し、「開発」ステージから「販売・事業化」ステージへと移行中である。
2022年4月、市場再編に伴い東証グロース市場に移行した。
【1-2 企業理念・経営理念】
社名のソレイジア(SOLASIA)は、Sol(ラテン語で太陽)+Asia(アジア地域)からなるもので、「日本・アジアにおいて、
がんと向き合うさまざまな人たちの未来を照らす希望の太陽でありたい。」という想いを表している。
以下のような、『経営理念:ミッション、ビジョン、バリュー』を掲げている。
|
果たすべき役割 (Mission) |
*患者さんの明るい未来のためによりよい医薬品を提供する。 |
|
在るべき姿 (Vision)
|
*国内外で認知され、全てのステークホルダーから高い信頼を得る。 |
|
*全員が、情熱と志、倫理観を持ち、現状を是とせず、高い専門性を保ち、常に未来志向で新しい価値・創造に努め、革新的医薬品を開発するスペシャリティ・ファーマとして認められる存在となる。 |
|
|
*当社の製品を必要とする人々(医療従事者及び患者さん)の要望に応え貢献する。 |
|
|
共有される価値観 (Value)
|
*患者さんのための価値を創造する。 |
|
*高い倫理観を持つ。 |
|
|
*互いに信頼し尊敬する。 |
|
|
*チームで活動する。 |
また、経営方針として以下の2点を示している。
|
① 当面、大手製薬企業が業績重視の観点から着手しないがん領域、希少疾病領域での新規製品の導入開発を進め、未だ治療薬がないような患者さんへの貢献を果たす。 |
|
② 製品の事業化を通じて、経営理念の実現を図るための財務基盤を早期に完成させ、企業として自立する。 |
ニッチではあるが困っている患者が多数いるアンメット・メディカル・ニーズ(いまだに治療法が見つかっていない疾患に対する医療ニーズ)解決のための新薬開発に注力していく。また、現在は研究開発が先行しているため財務CFに頼らざるを得ない現状であるが、早期に営業CF黒字化を実現し、持続的成長が可能な基盤を構築する。
【1-3 同社を取り巻く環境】
厚生労働省「令和2年(2020)人口動態統計月報年計の概況」によれば、2020年の主な死因別死亡率(人口10万人に対し何人が死亡したか)は悪性新生物(がん)が、307.0人で第1位であった。1981年に死亡率142.0人で、同134.3人の脳血管疾患に代わり第1位となって以来30年以上にわたり連続して第1位であり、その数値も年を追って上昇している。
日本では高齢化、また食生活を含めたライフスタイルの変化等によりがん発症率は上昇していると言われているが、中国においてもがんの発症者数及び死亡者数は増加傾向にある。
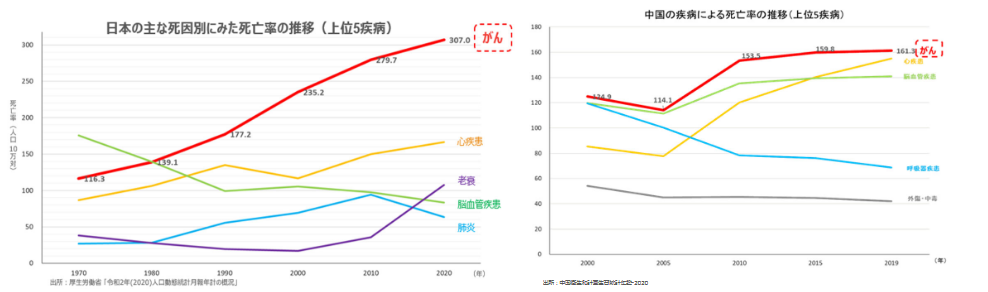
(同社資料より)
こうした中、2020年の世界の医薬品市場の売上は1兆3,054億ドル(約170兆円)。国別医薬品市場規模は第1位が米国で、2位は2013年に日本を抜いた中国、3位が日本。
今後、中国市場は米国市場と1位を分け合う規模まで拡大するとも言われている。
2位中国と3位日本で市場規模は合計2,298億ドル(約25兆円)。当面はこの巨大な市場が、同社のメインターゲットとなる。
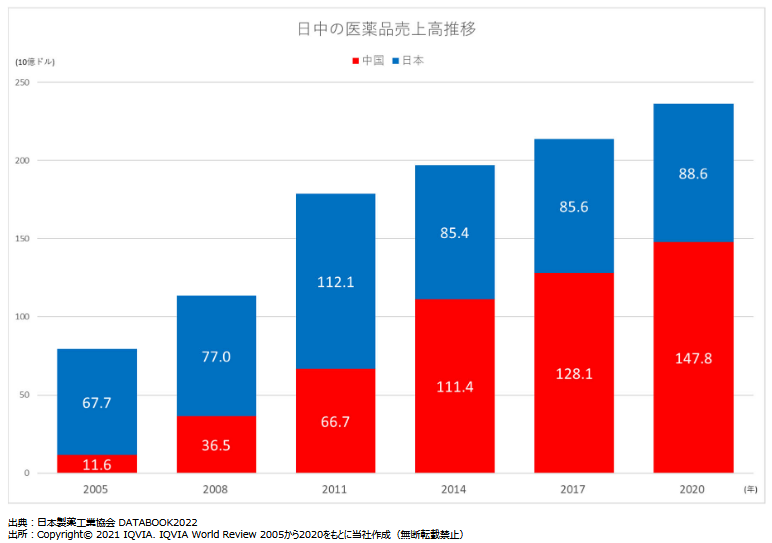
(同社資料より)
また、中国抗がん剤市場は3兆円超で全医薬品市場の1割強を占め、過去5年間CAGR約14%で成長している。
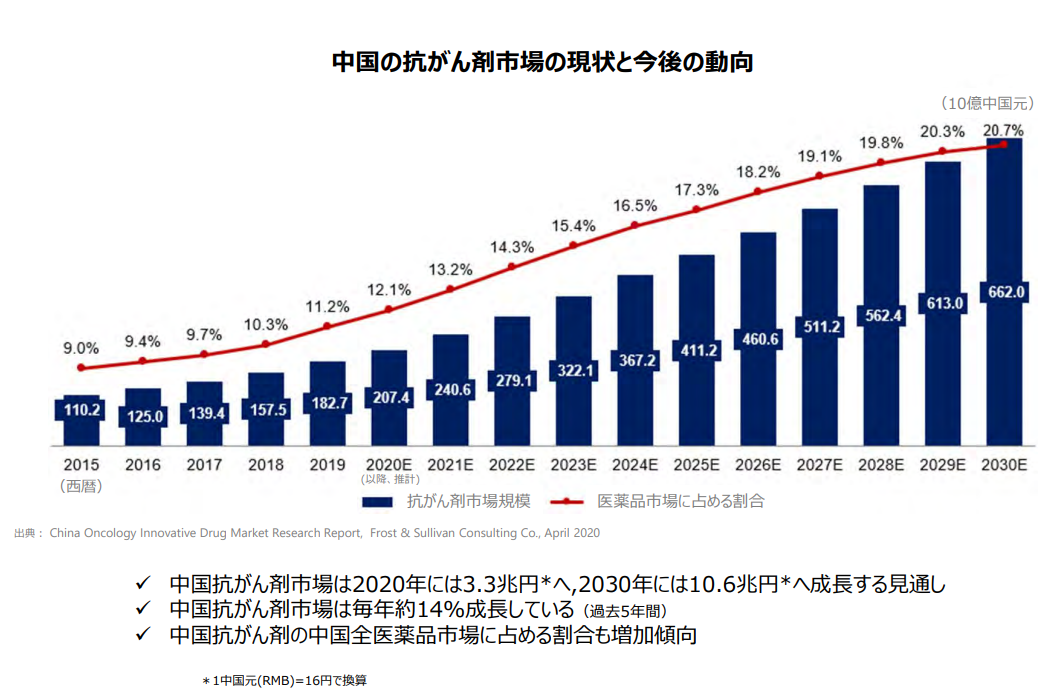
(同社資料より)
こうしたがんによる死亡率の上昇に伴い、世界的に「新規抗がん剤」および「がんサポーティブケア」への期待が高まっている。
(新規抗がん剤)
抗がん剤を用いたがん治療においては、一つの抗がん剤のみを用いる単剤治療よりも、複数の抗がん剤を用いる併用療法のほうが主流である。
加えて、がんは種類によって異なるが、再発の可能性が高く、加えて難治の場合は、一種類の治療での治癒は困難であるため、一つの治療薬が絶対的な存在とはならず、他の治療薬が直接的な「競合」とはなり難いという特性がある。また、近年では、分子標的薬や免疫療法が注目されてはいるが、まだ多くのがん種に対する治療において化学療法剤が重用されている。殺細胞性抗がん剤を含むレジメンは標準治療として位置づけられ、今後も高い医療ニーズが期待される。
(がんサポーティブケア)
抗がん剤はがん細胞を攻撃するなどの強力な医薬品であり副作用が避けられない。
患者に負担がかかる副作用をコントロールできなければ、抗がん剤の減量やがん治療そのものを中止せざるを得ず、結果的には病状が進行してしまうリスクがある。
こうした事態を避け、がん治療を完遂するためには、副作用のコントロールを行うための医薬品や医療機器への期待が高まっている。また、がんの治療薬はがんの種類ごとに承認を得なければならないが、サポーティブケアはがんの種類を問わず、幅広いがん患者への処方が可能であり、大きなニーズ、市場が見込まれる。
以上のように、日本・中国におけるがん治療ニーズの増大とそれに対応した新規抗がん剤およびがんサポーティブケアへの期待は大きく、同社はこうしたニーズを取り込み、収益を拡大させるためのビジネスモデル、事業戦略を構築している。
【1-4 事業内容】
(1)ビジネスモデル
新しい医薬品が上市されるまでには、「基礎研究」から始まり、「製剤研究」、「非臨床開発(動物を用いて薬効薬理作用、生体内での動態、有害な作用などを調べる試験)」、「臨床開発(医薬品や治療技術などの人間への影響を調べる科学的試験)」を経て、当局の承認を得たのち、「製造」、「販売・マーケティング・製造販売後調査」といったプロセスを経るのが一般的である。
大手製薬会社は、巨額な研究開発費を変動費化することなどを目的にCROを利用した臨床開発段階のアウトソーシングを進めてはいるが、基本的には上記の工程全てを自社内に保有している。
これまではこうした体制が製薬会社の高収益体制を支えてきたが、近年の生命科学分野の急速な進歩や複雑化、多様化により、自社固有の創薬技術が陳腐化してしまう可能性が高まっている。
また、多額の費用と時間をかけて基礎研究から進めても臨床開発に入るまでに実用化を断念し、創薬技術を確立できないケースも多く、医薬品開発には常に高いリスクがついてまわる。
そこで同社では、失敗の確率の高い基礎研究から非臨床開発の工程を自社では行わず、まだ開発段階にある将来有望な医薬品を外部から導入して臨床開発から開発に着手。それ以降の事業活動に経営資源を集約することで自社の強みを発揮するとともにリスクの低減を図っている。現時点ではコスト負担の大きい製造工程も保有しない計画である。
また、販売工程については、高収益確保とリスクコントロールのバランスを考慮した仕組みを構築している。
一般的に製薬企業の売上高総利益率は高水準であるが、これは、製造および販売活動を内製化することによって実現できると考えられる。
|
|
売上収益 |
売上総利益 |
売上総利益率 |
|
アステラス製薬 |
1,296,163 |
1,043,154 |
80.5% |
|
第一三共 |
1,044,892 |
691,563 |
66.2% |
*単位:百万円。22年3月期実績。
一方医薬品は販売地域の網羅性(例:日本全国をカバー)が要求され、自社販売網を構築しようとすれば、固定費が増大する。そこで同社では、臨床開発を終えた医薬品について、販売権を他社に導出する「導出モデル」を採用している。
(導出モデル)
現在の主な導出先パートナーは以下の4社である。
|
Meiji seika ファルマ株式会社 |
*明治グループの医薬品会社。がん、感染症、中枢神経系領域におけるスペシャリティ・ファーマ。多数のがん領域製品の販売実績を有している。 |
|
*「エピシル® (SP-03)」 日本権利パートナー |
|
|
日本化薬株式会社 |
*1916年創業。医薬事業では、がん関連製品に特化し、新薬からバイオシミラー、ジェネリックまでを手掛け、抗がん薬に必要な信頼性の高い情報を医療機関に提供している。 *「ダルビアス® (SP-02)」 日本権利パートナー |
|
Lee’s Pharmaceutical (HK) Limited |
*香港市場上場の中国系製薬会社。中国全土約30拠点を通じがん領域をはじめ、多数の医薬品の販売を行っている。 |
|
*「Sancuso® (SP-01)」 中国権利パートナー |
|
|
*「エピシル® (SP-03)」 中国権利パートナー |
|
|
マルホ株式会社 |
*1915年創業の医療用医薬品等の研究・開発・製造・販売を行う製薬企業。特に皮膚科学領域で強みを有する。 *「PledOx® (SP-04)」の日本権利パートナー |
今後も共同歩調が取りやすくWIN-WINの関係を構築できる中堅製薬メーカーを中心に導出先パートナーとして確保していく考えだ。
(2)中国におけるマーケティング体制
巨大な中国医薬品市場の開拓を目指す同社は、当初中国の3大都市「北京・上海・広州」においては製品販売利益の最大化と固定費管理を念頭に、自社販売体制を構築し自販モデルを展開していく計画で体制の構築を進めていたが、新型コロナウイルス感染症拡大に伴う都市封鎖の影響が大きく、想定通りの収益計画達成は困難と判断し、自社販売を断念した。
北京・上海・広州における「Sancuso® (SP-01)」および「エピシル® (SP-03)」の販売もLee’s Pharmaceutical (HK) Limitedが行う。
ポイント:中国医学界から高評価
新しい医薬品の使用・普及にあたっては影響力のある医師の判断や決定がその結果を大きく左右するが、中国もその例外ではない。
そうした状況の中、「Sancuso® (SP-01)」は臨床現場で参照されるがん治療に対する中国版NCCNガイドラインにおいて、既に悪心嘔吐の標準治療の一つとして推奨されている。
また、CSCO(中国臨床腫瘍学会)において中国のがん治療分野をリードする著名な臨床医が、「Sancuso® (SP-01)」について簡便にかつ化学療法全プロセスにおいて悪心・嘔吐を抑制する点を高く評価していることを受けて、CSCOが初めて発行した制吐薬適正使用ガイドラインにおいて、がん治療時の標準的な制吐療法の選択肢として「Sancuso® (SP-01)」が収載された。
こうした高評価を受けることができているのは「Sancuso® (SP-01)」自体の優れた効能はもちろんであるが、マネジメントチームがRoche時代から構築してきた中国臨床ネットワークとの強固なリレーションシップが大きな役割を果たしていることは明らかであり、他のバイオベンチャーにはない同社の大きなアドバンテージである。
(3)製品・開発パイプライン
現在、前述の経営方針に沿って以下5つの製品・開発パイプラインを有している。(2022年8月19日現在)
2020年に導入した「SP-05」に続き、パイプラインの拡充にも取り組んでいる。適応分野は基本的にがん関連であるが、これまでのように外部からの導入に加え、アライアンス先のエディットフォース社やジーンケア社との共同研究によりリサーチ機能を強化し、適応分野の拡大も視野に入れている。
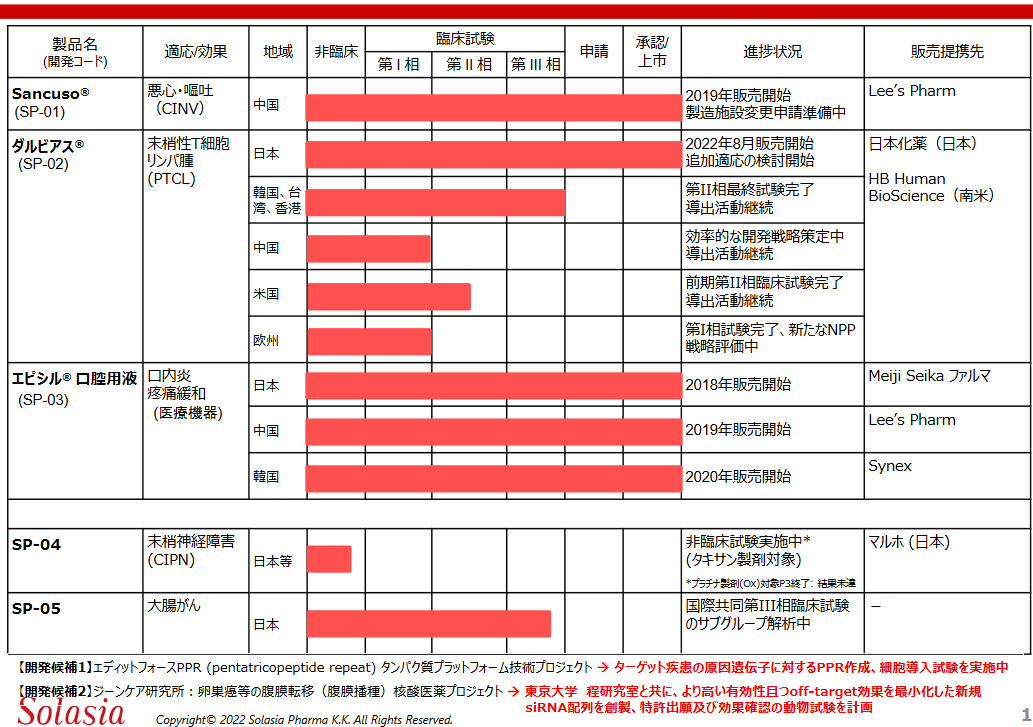
(同社資料より)
①「SP-01:経皮吸収型制吐剤 Sancuso®」(中国販売名:善可舒®)
|
項目 |
概要 |
|
|
効能・効果 |
がん化学療法による悪心・嘔吐 |
|
|
特徴・競合薬比較 |
*世界で唯一の経皮吸収型5HT3受容体拮抗剤。 |
|
|
*1回の投与(貼付)で5日間効果が持続することから、通常の化学療法(1~5日投与)の投与期間をカバーすることができる。外来使用も可能。 |
||
|
*2019年6月(上市3ヶ月後)、中国臨床腫瘍学会(CSCO)※発行初回ガイドラインに、がん治療時の標準的な制吐療法の選択肢として新たに収載。 |
||
*CSCO(Chinese Society of Clinical Oncology) : 中国における最大且つ最も権威あるがん関連学会
◎対象疾病の概要
抗がん剤の代表的な副作用として悪心や嘔吐はよく知られている。
抗がん剤を投与すると、小腸にあるクロム親和性細胞と呼ばれる細胞がダメージを受ける。
ダメージを受けたクロム親和性細胞はセロトニンという神経伝達物質を放出。これが末梢の迷走神経上にある5-HT3受容体に取りこまれ、その刺激が末梢の迷走神経に沿って、脳の第4脳室最後野にある化学受容器引金帯(CTZ)を介して延髄に入り、悪心・嘔吐の命令を生体に出す嘔吐中枢を刺激し、悪心や嘔吐が発現する。
悪心・嘔吐を抑制するためにはセロトニンによる5-HT3受容体への刺激を遮断することが必要であり、そのために用いられる薬剤「5-HT3受容体拮抗薬」としては様々なものがあるが、代表的な薬剤がグラニセトロンである。
◎「Sancuso® (SP-01)」概要
「Sancuso® (SP-01)」は、このグラニセトロンを含んだ5-HT3受容体拮抗薬の経皮吸収型製剤(貼付剤)で、貼り薬としては世界唯一。
|
 |
 |
 |
|
(中国販売用パッケージ) |
|
|
(同社資料より)
抗がん剤は5日間にわたり投与するケースが多いが、注射や経口による制吐剤は概ね1~2日間しか効果がなく、抗がん剤投与期間内に複数回注射しなければならない。これに対し「Sancuso® (SP-01)」は5日間にわたって安定的に血中のグラニセトロン濃度を維持することができるため、1回貼り付ければ制吐剤を追加する必要がなく、入院ではなく外来によるがん治療を可能とするため、患者のQOL向上にも大きく貢献する。
悪心・嘔吐、口内炎などが原因で、薬剤の服用が困難な状態にある場合でも、経皮吸収型製剤は使用可能である点も大きなメリットであり、以上のような点を評価され、米国NCCN診療ガイドライン、中国治療ガイドラインで処方推奨を得ている。
◎開発および販売状況
現在、米国、欧州、韓国等の20以上の国と地域で上市されている(他社による販売)。今後は、がん化学療法だけでなく放射線療法による悪心・嘔吐抑制への適応拡大を見込んでいる。
中国では2014年6月の承認申請完了を経て、18年7月に承認および市販用製剤の輸入許可を取得。これを契機に18年12月期第3四半期にはマイルストンを受領し売上収益を計上した。
その後、市販用製品の製造工程が確立し、初回出荷の対象となる製品製造が完了したことを受け、18年11月、中国販売代理店契約を締結している直接的な販売先である伊藤忠商事向けに出荷を開始した。
その後、中国通関の諸手続も完了し、予定通り2019年3月、販売を開始した。
前述のように、中国全土において販売権導出先であるLee’s Pharma社が販売活動を行う。
中国主要臨床医の評価コメント
販売開始にあたり、2019年3月16日、同社は「Sancuso®上市セミナー」を上海で開催(共催)した。
CSCO(Chinese Society of Clinical Oncology:中国臨床腫瘍学会)の理事長であるLi Jin教授、副理事長であるQin Shukui教授及びMa Jun教授を議長とし、中国全土から総勢約200名のがん専門医が一同に会した同セミナーにおいて、中国主要臨床医は以下のようなコメントを述べ、「Sancuso® (SP-01)」を評価している。
Qin Shukui教授(CSCO副理事長)
「制吐剤を処方しなければ、がん化学療法の患者の70-80%において、CINV(がん化学療法による悪心・嘔吐)が生じることとなる。悪心・嘔吐が重症な場合は、化学療法の薬剤投与を減量するか中止しなければならず、治療結果に対して悪影響を招く。従来、中国では、CINV予防として主に効果発現時間の短い注射剤が使用されてきた。注射剤は血中濃度が大きく変動するため、繰り返し投与する必要があり、患者にとって利便性が低い。Sancuso®はグラニセトロンを最長7日間、毎日持続的に放出するよう設計された独自の経皮吸収型製剤であり、化学療法1サイクルに対し1枚の使用で効果が期待できるため、化学療法を受ける患者にとって新しい非侵襲性の選択肢となるだろう。」
Ma Jun教授(CSCO副理事長)
「高度および中等度催吐性の化学療法を受けている患者における悪心・嘔吐リスクは、化学療法を受けた後2~3日間続くことになる。数日間にわたる化学療法では、急性悪心・嘔吐と遅発性悪心・嘔吐が重複することとなり、それに対してより安定した長期持続性のCINV治療薬が必要となる。Sancuso®は想定される急性および遅発性の悪心・嘔吐を含む様々な段階をカバーすることが可能であり、7日間の安定した有効性は、化学療法全プロセスでのCINV管理を可能にし、患者は安心して化学療法を受けることができるようになるだろう。」
Li Jin教授(CSCO理事長)
「Sancuso®は、中国において化学療法を受ける患者の悪心・嘔吐予防の新しい非侵襲性の選択肢となるだろう。投与は貼付剤ゆえに簡単で、且つ長時間効果が持続するため、化学療法全プロセスでのCINV管理が容易となり、CINVの治療効果を向上させるだろう。」
CSCOとして初となる制吐薬適正使用ガイドラインを発行
上市3か月後となる2019年6月、CSCOが初めて制吐薬適正使用ガイドラインを発行し、がん治療時の標準的な制吐療法の選択肢として「Sancuso® (SP-01)」が収載された。
ガイドライン編集委員長でCSCO副理事長のQin Shukui教授は、「高度/中等度催吐性リスク抗がん剤に対する制吐療法として、本ガイドラインではSancuso®を推奨する。化学療法を受ける患者にとって新しい非侵襲性で且つ安全な選択肢となる。」とコメントしている。
同社では「Sancuso® (SP-01)」の特徴や競合薬に対する優位性にかかるKey Opinion Leaderと呼ばれる臨床医の評価の獲得、医療現場の臨床医への知見提供という上流・下流2方向の営業活動を展開。
数量ベースで6%成長し、800億円以上といわれる中国5-HT3 RA制吐剤市場でのシェア獲得を目指している。
②「SP-02:新規化学療法剤 ダルビアス®」
|
項目 |
概要 |
|
対象疾病 |
再発・難治性の末梢性T細胞リンパ腫(PTCL) |
|
特徴・競合薬比較 |
*欧州では未だPTCL適応での承認薬はない(日米は他剤上市済)。 |
|
*日・米で承認されている製品と比較して、重い副作用(骨髄抑制、口内炎)が報告されておらず、安全性が高く長期間投与或いは併用投与も期待できる。 |
(対象疾病の概要)
悪性リンパ腫は、血液がんの1つで、白血球の中のリンパ球ががん化したもの。
リンパ球には、B細胞、T細胞、NK細胞等の種類があり、これらががん化して無制限に増殖することで発症する。
末梢性T細胞リンパ腫(PTCL:Peripheral T-cell lymphoma)とは、悪性リンパ腫の種類の1つ。リンパ球の中のT細胞から発生するもので、月単位で病気が進行する「中悪性度」に分類され、中悪性度リンパ腫の10~15%を占めるといわれている。B細胞リンパ腫などに比べ、5年生存率は低く、25%前後である。
推計患者数(日本)PTCL患者数: 約4,000人/年*
(開発および販売状況)
「ダルビアス® (SP-02)」は、この再発・難治性の末梢性T細胞リンパ腫(PTCL)への適応で開発をスタートさせた。
米国における前期第Ⅱ相臨床試験は2012年4月に完了し、白人種における一定の有効性を確認した。
2015年4月に完了した日本および韓国における第Ⅰ相臨床試験では、PTCL患者において安全性及び忍容性が確認され、アジア人種における一定の有効性が示唆された。
また、日本、韓国、台湾、香港で2016年にスタートした最終試験として位置づけられるアジア国際共同第Ⅱ相臨床試験は、2019年9月、患者組入が完了した。
当初予定通り、2020年6月に統計解析を経た試験結果が公表され、主要評価項目である「抗腫瘍効果」が達成されたほか、副次的評価項目においても安全性上の懸念は確認されず、良好な結果を得ることができたことを受け、2021年6月に、世界に先駆けて日本において製造販売承認申請を提出した。
2022年6月20日、「再発又は難治性の末梢性 T 細胞リンパ腫(PTCL)」を効能又は効果として、抗悪性腫瘍剤/有機ヒ素製剤ダルビアス®が厚生労働省より製造販売承認を取得し、薬価収載を経て8月22日に、販売パートナーである日本化薬を通じて販売を開始した。
韓国・台湾・香港では販売権導出契約締結以降に承認申請を提出する予定。
中国においては最終試験である第Ⅱ/Ⅲ相臨床試験および権利導出の検討中。米国では前期第Ⅱ相臨床試験が完了。欧州では、前臨床試験が完了し、第II相 / III相 臨床試験準備中。いずれも権利導出の交渉中である。
同社は全世界権利を有しており、日本での開発販売権は日本化薬に、コロンビア共和国のHB Human BioScience SAS社には、コロンビア、ペルー、エクアドル、ベネズエラ、チリ、パナマ、コスタリカ及びグアテマラでの販売等の独占的権利を導出している。
米国での導出、欧州やインドにおけるNamed Patient Program(既に承認済で販売されている製品を患者と医師の判断で輸入する仕組み)導入による評価など、導出活動を継続している。
悪性リンパ腫はしばしば再発することが知られており、作用機序の異なる複数の治療薬が必要でマーケットは大きいと同社は考えている。
末梢性T細胞リンパ腫を対象とした他剤との併用による相乗効果を検証・提案することで使用拡大を追求するほか、その他血液がん(ATLL(成人T細胞白血病/リンパ腫)やAML(急性骨髄性白血病))や固形がんへの適応拡大を目指しており、現在、非臨床試験も並行して実施している。
2020年10月に開催された「第79回日本癌学会学術総会」では、新たに、成人T細胞白血病・リンパ腫(ATL)の治療薬となりうる可能性が示唆された。
がん治療薬及びがんサポーティブケア(がん支持療法医薬品等)を中心に開発を進めている同社のパイプラインの中で、現時点で唯一の開発が完了した「がん治療薬」として今後の成長が期待される。
➂「SP-03:医療機器 エピシル® 口腔用液」
|
項目 |
概要 |
|
使用目的 |
化学療法や放射線療法に伴う口内炎で生じる口腔内疼痛の管理及び緩和を物理的作用により行う。カテゴリーは医療機器。 |
|
特徴・競合薬比較 |
*がん等の化学療法や放射線療法による口内炎に対する標準的対処法はなく、病院毎での対症療法に頼っており、新しい対処法が強く求められている。 |
|
*薬効成分を含まないため副作用がなく、抗がん剤との相互作用もない。 |
(対象疾病の概要)
抗がん剤による悪心・嘔吐と並んで、がん化学療法又は放射線療法による口腔粘膜障害の副作用も患者にとっては大きな困難である。
口内炎は、「化学療法が口腔粘膜へ直接作用して障害が生じるもの」や「放射線照射により唾液腺組織に障害が生じ、唾液の分泌低下により口腔内の自浄作用が低下し局所感染が起こることで発生するもの」である一次口内炎と、「白血球減少などに伴う骨髄抑制により起こる口腔内感染が原因となるもの」である二次口内炎がある。
抗がん剤治療に伴う口内炎の発生頻度は30~40%、抗がん剤と頭頸部への放射線治療併用時の口内炎発生頻度は約100%となっている。
がん化学療法又は放射線療法による口内炎は、300~500もの多数の炎症が発生するものもある。その疼痛により患者は食事や水分の経口摂取が困難になり体力低下を招き、重症化すると本来のがん治療の継続にも悪影響を及ぼしてしまう。これまでは確立した標準治療はなく、病院ごとでの対症療法が主流であった。
(「エピシル® (SP-03)」概要)
「エピシル® (SP-03)」は、脂質ベースの液体を口腔粘膜に滴下塗布するものであり、同社ではカテゴリーとしては医療機器として開発を進めてきた。
(同社資料より)
口腔粘膜に適量を適用すると、数分以内に液体が口腔内の水分を吸収し生体接着ゲル化し、物理的なバリヤーを形成するもので、8時間程度の口内炎の疼痛緩和効果が臨床的に示されている。
(開発および販売状況)
2016年に日本における承認申請を完了していたが、2017年7月6日付けで、厚生労働省より、日本国内における医療機器製造販売承認を取得した。2018年1月には第388回中央社会保険医療協議会総会において18年4月からの保険適用が承認され、保険収載(7,660円/本、10ml入:2019年10月時点)を経て、18年5月、日本における独占販売権の導出先であるMeiji Seika ファルマ株式会社による販売が開始された。
中国においても2016年5月の承認申請後、2019年2月、医療機器輸入販売承認を取得したのを受けて、2019年7月に販売を開始した。
前述のとおり、中国全土において販売権導出先のLee’s Pharma社が販売活動を行っている。
2021年5月、中国臨床腫瘍学会(CSCO)が新たに発行した「がん治療による急性口腔粘膜炎の診断と予防に関する臨床診療ガイドライン」に、「エピシル® (SP-03)」が収載され、新たな治療選択肢として推奨された。
このガイドラインは、「臨床腫瘍医の口腔粘膜炎に対する関心を高め、がん治療における口腔粘膜炎の治療を標準化することであり、非常に大きな意義がある」と位置付けられており、口腔粘膜障害の治療薬として「エピシル® (SP-03)」が具体的に取り上げられたことで、中国における拡販に弾みがつくものと同社では期待している。
同社では、「エピシル® (SP-03)」の商品特性から、既存市場を開拓するのではなく「市場を創出する」というスタンスで事業を展開する。日本・中国で200~300億円のマーケットを想定しており、30~50%のシェア獲得を目指す。
韓国においては2018年8月、導入元であるCamurus AB社と韓国での独占開発販売権利を導入する契約を締結し、2019年3月、当局へ承認申請を行っていたが、同年10月韓国における医療機器輸入販売承認を取得。2020年1月には、韓国での販売パートナーとしてSynex社と独占的販売ライセンス契約を締結した。2020年9月、当初予定通り販売が開始された。
また、Camurus AB社との間で製品供給に一時的に見解の相違が生じたものの、2022年7月には製造権を含む全世界事業権利を取得した。事業移管完了は2024年を予定している。
当面は日本、中国及び韓国での製品供給に注力する。日本、中国及び韓国以外の地域の事業化方針は事業移管終了までに決定する予定。
製造権取得により、例えばスウェーデンから日本へ製造施設を変更しソレイジア・ファーマが直接製造業者から購入するなど、製品調達原価低減の可能性について評価を開始した。
④「SP-04:細胞内スーパーオキシド除去剤 PledOx®(プレドックス)」
|
項目 |
概要 |
|
対象疾病 |
がん化学療法に伴う末梢神経障害 (Chemotherapy Induced Peripheral Neuropathy:CIPN) |
|
特徴・競合薬比較 |
*がん化学療法に伴う末梢神経障害に対する承認医薬品は存在しない。 |
|
*生体に悪影響を及ぼす細胞内活性酸素の一種スーパーオキシドを分解する酵素スーパーオキシド・ジスムターゼ様の作用を持つ新規に化学合成された金属複合体(キレート)。 |
先行する3つの開発がおおむね順調に進む中、4つ目のパイプライン導入を上場時から検討していた同社は、「がん領域である。」、「臨床試験が一定程度進んでいる。」、「日本及び中国での開発権利を獲得できる。」という3つの条件を満たす新薬を探していた。そして、2017年11月にスウェーデンのEgetis Therapeutics AB(旧、PledPharma AB以下「Egetis社」)から、がん化学療法に伴う末梢神経障害薬「PledOx®」の日本、中国、韓国、台湾、香港及びマカオでの開発事業化の独占的権利を獲得した。
(対象疾病の概要)
がん化学療法は、悪心・嘔吐や口内炎発症等の副作用が生じるが、末梢神経障害(CIPN)も重篤な副作用の一つ。CIPNは、プラチナ製剤やタキサン製剤等のがん化学療法の主要薬剤において、顕著に「手、足や口唇周囲部等の異常感覚」、「呼吸困難や嚥下障害を伴う咽頭喉頭の絞扼感(しめつけ)」、「手足先のしびれ」、「感覚低下」、「感覚性運動失調」などの症状を発現することが知られている。
このような副作用が発現した場合には、薬剤中止により、80%の症例では一部症状の改善がみられ、40%の症例では 6~8 ヵ月後には完全に回復するが、薬剤中止はがん化学療法の中止や方針変更となる可能性があり、CIPNの治療は医療上の重要な課題である。ただ、がん化学療法の副作用としての末梢神経障害を適応として当局に承認された医薬品は現時点では存在していない。
推計患者数(日本) 約70,000~180,000人/年*2(タキサン製剤投与)
(「PledOx® (SP-04)」概要)
「PledOx® (SP-04)」の導入元Egetis社はストックホルム証券取引所に上場しており、酸化ストレス関連の疾患に対する医薬品開発に強みを持つ。「PledOx®」(有効成分名:calmangafodipir)は欧米で販売実績を有するMRI造影剤「Mangafodipir」を基に創生された新有効成分である。
(開発および販売)
◎開発状況
欧米に加え、日本、韓国、台湾及び香港も参加して2018年12月にオキサリプラチン投与に起因する末梢神経障害を対象とした国際共同第Ⅲ相臨床試験を開始したが、Egetis社が実施しているPOLAR-M試験に関して、2020年1月にFDAより、クリニカルホールド(実施保留命令)が発せられたほか、フランス医薬品・保健製品安全庁(ANSM)より実施保留命令が発せられるなど、複数の当局からの試験中断命令を受けた。
その後、独立データ安全性モニタリング委員会が、新たな安全性評価において、オキサリプラチンと SP-04 の複数回の反復投与後に複数件の重度アレルギー反応と過敏症が発現していることから、本試験の新規被験者登録と治験薬投与の停止を勧告したため、ソレイジア・ファーマとEgetis社は当初計画されていたプロセスを変更し、症例データ収集の早期締め切り「データカットオフ」を2020年第3四半期(7‐9月)に行い、その上で第Ⅲ相国際共同臨床試験を終了することとした。
また、ソレイジア・ファーマは、臨床試験遂行において最も重要なのは被験者の安全性確保であるとの認識の下、試験終了によって得られる情報を中心に安全性と有効性に関する詳細且つ強固な評価を行い、その後の 「PledOx® (SP-04)」の計画を策定するという方針を示した。
以上のような経緯を経て、第Ⅲ相国際共同臨床試験の速報結果が、2020年12月に公表された。
結果は、有効性にかかる主要評価項目は未達、有害事象の発現頻度及び内容は、化学療法及び本試験対象である大腸がんに起因する予想されていた事象と概ね一致していた、というものであった。
ソレイジア・ファーマとEgetis社は、この試験結果は主要評価項目に関する情報に限定されるため、今後、副次評価項目等の試験結果の詳細について更に評価し、今後の「PledOx® (SP-04)」開発戦略の検討を図ることとしている。
そうした中、ソレイジア・ファーマでは、白金製剤であるオキサリプラチンでの開発を留保し、タキサン製剤誘発末梢神経障害を対象とした開発の可能性を探索するため、追加の動物試験を実施している。
現時点では、試験プロトコルで予め定められた一部の評価項目において、「PledOx® (SP-04)」のタキサン製剤誘発性末梢神経障害に対する発症抑制効果の可能性が示唆された一方、同効果が示されない評価項目も存在しており、試験全体の結果解釈は複雑で、タキサン誘発末梢神経障害に対する 「PledOx® (SP-04)」の明確な発症抑制効果の確認には至っていない。
◎導出計画
ソレイジア・ファーマでは日本、アジアでの権利導出を検討中であるが、日本においては2019年12月、マルホ株式会社(大阪府大阪市)と「PledOx® (SP-04)」の独占的日本国内販売権の導出契約を締結した。
この契約の経済条件は、「マルホはソレイジア・ファーマに契約一時金10億円を支払う」、「マルホはソレイジア・ファーマに今後の開発及び販売の進捗に応じたマイルストン最大総額約180億円の支払を行う」、「ソレイジア・ファーマはマルホに対してPledOx® (SP-04)を独占的に販売する」というものである。
⑤「SP-05:arfolitixorin」
|
項目 |
概要 |
|
対象疾病 |
抗がん剤「フルオロウラシル」の抗腫瘍効果の増強(様々ながん治療、特に大腸がん) |
|
特徴・競合薬比較 |
*第I/IIa相臨床試験において、標準治療法とされる大腸がん化学療法レジメンと比較して、抗腫瘍効果の増強が示唆された。 |
|
*現在実施中の第III相試験の結果をもって、「新たな標準治療法」としての大腸がん化学療法レジメン入りを目指す。 |
2020年8月、新たなパイプラインとしてIsofol Medical AB(スウェーデン)と、Isofol社が開発するarfolitixorin(ソレイジア・ファーマ開発品コード:SP-05、一般名:arfolitixorin)の日本における開発事業化の独占的権利導入契約を締結した。
契約一時金、開発進捗と開発成功後の売上高達成に応じたマイルストンにかかるIsofol社への支払及び開発投資として合計最大で104億円を支払う見込みで、このほか、Isofol社に対して、販売開始後の売上高に応じたロイヤリティを支払う。
(「arfolitixorin(SP-05)」概要)
様々ながん治療、特に大腸がん等で標準療法に用いられる既存抗がん剤「フルオロウラシル(5-FU)」は、DNA合成に必要な化学物質チミジンを欠乏させることによりDNA合成を阻害し、腫瘍細胞を死滅させる。
大腸がん(結腸・直腸がん)の標準療法として、「フルオロウラシル」と当該製剤の抗腫瘍効果増強に用いられる葉酸製剤「レボホリナート/ホリナート」を併用することが多いが、その場合、体内で複雑な活性代謝物変換が必要となり、必ずしも安定した効果を期待することができないという課題があった。
これに対し、「フルオロウラシル」とともに「arfolitixorin(SP-05)」を投与した場合は、最終活性代謝物である「arfolitixorin(SP-05)」を投与することでチミジン欠乏の作用を増強させ、「レボホリナート/ホリナート」併用時を超える「フルオロウラシル」の抗腫瘍効果の増強が期待できる。
Isofol社の実施した第II相までの臨床試験等の結果、進行大腸がん(結腸直腸がん)患者において、フルオロウラシルの有効性を増強する効果が示唆されている。
複雑な代謝活性化を必要としないことから、進行大腸がんのすべての患者に有効性をもたらす可能性があるほか、大腸がん以外に、膵臓がん、小腸がん、乳がん、胃がんなどの治療にも有効性をもたらす可能性がある。
(Isofol社概要)
Isofol社は、進行大腸がんに対する標準化学療法の有効性を向上させ、腫瘍反応と無増悪生存期間を向上させることを目的とした薬剤「arfolitixorin」を研究開発しているスウェーデンのバイオテクノロジー企業。ビッグ・ファーマの1社メルク社と世界的な独占的ライセンス契約を締結しており、arfolitixorinのがん適応症の開発と商業化を目指している。ストックホルム証券取引所上場。
(開発状況)
2018年12月より、Isofol社は米国、カナダ、欧州、オーストラリア、日本地域において「arfolitixorin(SP-05)」の第Ⅲ相臨床試験を実施してきたが、導入契約により日本での同試験をソレイジア・ファーマが引き継ぐこととなり、2020年8月より試験を実施している。
目標症例数を440~660症例と設定し、330症例をもって中間解析を実施することとしていたが、20年7月に症例数は330例に達し、20年12月には440例に到達した。
中間解析においては、同試験に設置された独立データ安全性モニタリング委員会によって、安全性と有効性の評価に基づき同試験の継続可否、また同試験を継続する場合における最終登録被験者数(440症例乃至660症例)が推奨されることとなっていたが、2021年3月22日、同委員会より「中間解析にかかる安全性及び有効性の評価(ORR: Overall Response Rate, 全奏効率及びPFS:Progression-Free Survival, 無憎悪生存期間)に基づき、症例予定数を最小目標値440症例として試験を継続することを勧告する」との連絡を受けた。
同社では、この勧告は、「SP-05による毒性増強の兆候が見られず、症例追加することなく治験実施計画書に規定された最小目標症例数440症例で試験を継続することで、当該試験の有効性の主要評価項目であるORR及び副次評価項目であるPFSを達成できる可能性が示唆されたもの」と考えている。
そのため、「最小目標症例数で試験を継続できることで、SP-05を治療現場にお届けすることを目標とした次段階に向けて、最短期間で開発を進められることを期待している」とのことだ。
その後、2021年5月に国内での被験者組入れも完了し、試験全体での被験者組入れが完了。中間解析結果も確認した。
21年11月には、Isofol社が、「arfolitixorin (SP-05)」の進行大腸がん(結腸直腸がん)適応に対し、米国食品医薬品局(FDA)がファスト・トラック指定を行ったと公表した。
FDA のファスト・トラック指定は、アンメット・メディカル・ニーズを満たす治療困難な疾患に対する治療薬等の開発を促進し、迅速に審査するために制定された制度で、FDA とのより綿密な連携、承認申請における逐次審査が可能となり、関連する基準を満たす場合には、米国での優先審査の対象となり得る。
Isofol社は、罹患率や致死率が高いとされる進行大腸がんに対する新規治療薬としてのarfolitixorin の可能性をFDA が評価し同指定を決定したと解説している。
この指定は、より早期に「arfolitixorin (SP-05)」を医療現場に提供するための重要な布石になると、ソレイジア・ファーマは考えている。
22年4月にはIsofol社が、同第Ⅲ相試験のデータ解析を開始したと公表した。このデータ解析開始は、同試験の副次評価項目である無増悪生存期間について解析開始に必要なイベント(被験者の病勢進行若しくは死亡)数等を米国食品医薬局(FDA)と協議した結果、決定されたもの。
22年8月、第Ⅲ相臨床試験のトップライン速報結果が公表されたが、残念ながら、グローバルデータでの ORR(全奏効率:主要評価項目)及びPFS(無憎悪生存期間:副次評価項目)につき、arfolitixorin 併用群は標準療法群に対して統計学的に有意な改善を示さなかったと公表された。
こうした結果ではあったが、同社では「arfolitixorin (SP-05)」実用化の道筋は十分あると考えており、今後は、対象を日本人患者に絞ったサブグループ解析、更新PFS解析、OS解析(全生存期間)等の結果をIsofol社と共同で見極め、製品化可否等の開発方針を決定する。
ソレイジア・ファーマでは、SP-05を同社の革新的ながん治療薬ポートフォリオをさらに拡充する重要な薬剤と位置付けている。
国内において年間15万人以上の患者が大腸がんと診断されており、Isofol社との共同開発により、日本の進行大腸がんの患者に新たな治療選択肢を提供する考えだ。
【1-5 成長イメージ】
以上のパイプラインの販売・開発を計画通り進め事業化を図り、早期の研究開発費を除いた営業利益の黒字化達成を実現させるとともに、引き続き新たな開発にも取り組み成長を続け、企業価値向上と患者・株主を含めた全てのステークホルダーへの貢献を目指していく。
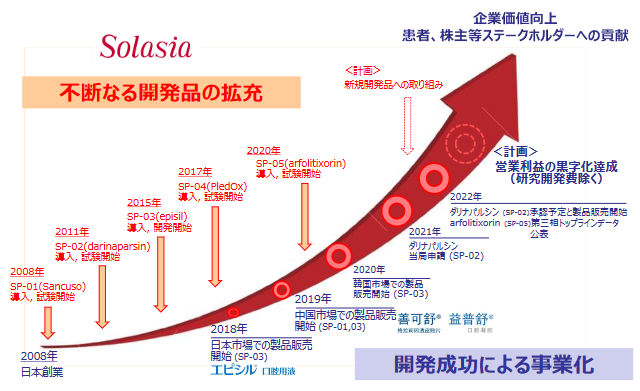
(同社資料より)
【1-6 バイオベンチャーとしての6つの特徴】
バイオベンチャーとしての同社を特徴づけるのは主に以下の6点である。
➀創業の経緯
同社のスタートは、伊藤忠商事と米国のバイオに特化したVCであるMPMキャピタルによって設立された「JapanBridge (Ireland) Limited」。数社のバイオベンチャーから新薬の権利を導入し、開発を進めた。
当初はExitとして製薬会社への売却を中心に考えていたが、事業の将来性、有望性から企業として永続的に事業を展開する方向にシフトし、研究開発に向けた資金調達も必要なため株式公開の道を選択。その後、2017年3月に株式公開を果たした。もともと他社への売却を念頭に置いていたことから、保有する開発品は開発段階ではあっても他社に売却して現金化可能な優良な資産で構成されており、創業時より既に強固な事業基盤を構築している。
➁実務経験豊富な臨床開発陣
研究部門や前臨床部門を持たず、新薬開発の権利導入を活用し、臨床開発以降の医薬品創造プロセスに特化している。医薬品事業化への研究開発過程において最も大切なのは最終的に当局の承認を取得することであるが、そのためには臨床開発、特に第Ⅱ相以降の後期臨床段階におけるスキルやノウハウが最も重要である。
数多い日本のバイオベンチャーの中でも、社長が臨床開発をコアスキルとして身に付け、強力な武器としているのは同社荒井社長以外には見当たらない。
荒井社長率いる実務経験豊富な臨床開発スタッフは同社の強力な差別化要因、競争優位性である。
➂開発成功確率の高さ
これまでに、「Sancuso® (SP-01)」、「ダルビアス® (SP-02)」、「エピシル® (SP-03)」、「PledOx® (SP-04)」、「arfolitixorin(SP-05)」と5つの開発品を導入しており、4つの開発品が事業化又は事業化に至る最終段階にある。
(「Sancuso® (SP-01)」は中国で販売開始、「ダルビアス® (SP-02)」は承認申請準備中、「エピシル® (SP-03)」は日本及び中国、韓国で販売開始)にある。「arfolitixorin(SP-05)」は、第Ⅲ相国際共同臨床試験実施中。)
この高い開発成功確率を可能にしているのは2つの要因である。
1つ目は、失敗のリスクの低いものを選定し導入するビジネスモデル。
2つ目は、臨床開発のすべてを担うことのできるチームが社内にあること。前述のように、承認を取るためには何が必要かを熟知した開発陣は、導入品が承認をとれるか否かについてのスクリーニングをかけることができる。
1つ目、2つ目を合わせた、いわば「目利き力」が、開発断念に至るリスクを引き下げ、高打率の源泉となっている。
新薬のキャッシュインフローをDCF(ディスカウント・キャッシュフロー)モデルから分析してみると、将来にわたるトータルのキャッシュインフローの大部分を構成するのは契約金やマイルストンではなくロイヤルティであるが、言うまでもなくロイヤリティは最終的に開発が成功し、販売が拡大しないと獲得することはできない。
Egetis社(スウェーデン)への提案に際し、多くの競合に比べ、契約金を始めとした金額面では決して有利ではなかったにもかかわらず「PledOx® (SP-04)」を導入できたのも、明確な臨床開発設計を構築できるチーム力、先行3製品の開発実績、日本・中国を含めたアジアでの実績などをEgetis社が評価し、ソレイジア・ファーマがアジアにおける「PledOx® (SP-04)」成功のためのベストパートナーと判断したものであろう。
また「SP-05」に関しても、こうした実績が、高い評価・導入に結び付いているようだ。
➃安定した事業基盤
開発品4つにおいて、製薬企業への販売権導出を達成しており、自社販売と組み合わせたリスクヘッジのためのポートフォリオを構築済である。
⑤事業の早期実現
バイオベンチャーの場合、新薬開発段階では損失を計上しているのが一般的であるため、株価や事業価値の算定において損益計算書を使用することは合理的ではなく、DCFモデルを使用することとなるが、バイオベンチャーを対象とする場合、通常のDCFで使用される「時間」を基にした割引率以外に、新薬の臨床段階ごとの成功確率が割引率として考慮される。
この場合、承認をいつ得ることができるかが最大のポイントとなるが、5つの開発品のうち、「エピシル® (SP-03)」は国内及び中国・韓国で販売が開始され、次いで「Sancuso® (SP-01)」も中国で販売が開始となり、「ダルビアス® (SP-02)」の日本での販売が開始された。同社の新薬開発に関する割引率は、他のバイオベンチャーよりも低く想定されてしかるべきであろう。
以上6点以外に中国市場での成長ポテンシャルの高さを挙げることができる。
世界のメガファーマも当然中国をはじめとしたアジア各国に拠点を設けているが、同社が開発の対象とするのは経営方針にあるように、大手製薬企業が業績重視の観点から着手しないがん領域や希少疾病領域での新規製品である。近年、医薬品市場で注目を浴びるこうした製品はバイオベンチャー発のものであるが、大手は取り扱わないため、既に中国医学界から高い評価を得ている同社は世界中のバイオベンチャーにとって急成長するアジア市場へのアクセスを提供できる貴重な存在となろう。
2.2022年12月第2四半期期決算概要
(1)連結業績概要
|
|
21/12期2Q |
22/12期2Q |
前年同期比 |
|
売上収益 |
278 |
189 |
-88 |
|
売上総利益 |
120 |
127 |
+6 |
|
研究開発費 |
617 |
347 |
-269 |
|
販管費 |
865 |
1,008 |
+142 |
|
営業利益 |
-1,362 |
-1,228 |
+133 |
|
税引前利益 |
-1,383 |
-1,233 |
+150 |
|
四半期利益 |
-1,394 |
-1,247 |
+147 |
*単位:百万円。四半期利益は親会社の所有者に帰属する四半期利益。
売上収益は前年同期比88百万円減の1億89百万円。
内訳は主に「Sancuso® (SP-01)」および「エピシル® (SP-03)」の製品販売収益。
研究開発費は、同2億69百万円減の3億47百万円。
主に、「ダルビアス® (SP-02)」の製造販売承認に関する費用、「arfolitixorin(SP-05)」の第III相臨床試験(最終試験)の臨床開発投資。
販管費は、同1億42百万円増の10億8百万円。中国自販体制解消関連一時費用の一部発生で増加した。販管費のうち償却費は2億19百万円。「Sancuso® (SP-01)」および「エピシル® (SP-03)」の無形資産償却費用等。
これらの結果、営業損失は同1億33百万円縮小し12億28百万円となった。
(2)財務状態
◎主要BS
|
|
21年12月末 |
22年6月末 |
増減 |
|
21年12月末 |
22年6月末 |
増減 |
|
流動資産 |
894 |
1,046 |
+152 |
流動負債 |
489 |
442 |
-47 |
|
現金等 |
714 |
973 |
+259 |
営業債務等 |
386 |
333 |
-53 |
|
営業債権等 |
126 |
35 |
-91 |
非流動負債 |
67 |
39 |
-28 |
|
棚卸資産 |
0 |
2 |
+2 |
負債合計 |
556 |
482 |
-74 |
|
非流動資産 |
2,249 |
2,025 |
-224 |
資本合計 |
2,587 |
2,590 |
+3 |
|
無形資産 |
2,079 |
1,866 |
-213 |
利益剰余金 |
-5,204 |
1,077 |
+6,281 |
|
資産合計 |
3,144 |
3,072 |
-72 |
負債純資産合計 |
3,144 |
3,072 |
-72 |
*単位:百万円。現金等は現金及び現金同等物。営業債権等は、営業債権及びその他の債権。営業債務等は営業債務及びその他の債務。
「Sancuso® (SP-01)」および「エピシル® (SP-03)」の資産償却による無形資産の減少などで資産合計は前期末に比べ72百万円減少し、30億72百万円となった。
営業債務等の減少などで負債合計は同74百万円減少の4億82百万円。
無償減資、資本剰余金の利益剰余金への振替などで、資本合計は同3百万円増加し25億90百万円。自己資本比率は前期末より2.0%上昇し84.3%となった。
(3)トピックス
①「ダルビアス® (SP-02) 」が承認を取得し販売開始
22年6月、「ダルビアス® (SP-02) 」が承認を取得し、8月に販売を開始した。
(詳細は「会社概要-事業内容-(3)製品・開発パイプライン」を参照)
②「エピシル® ( SP-03)」に関し全世界での事業権利を取得
22年7月、導出元のCamurus AB社から「エピシル® ( SP-03)」の製造権を含む全世界事業権利を取得した。一時期生じていた見解の相違は解消した。
(詳細は「会社概要-事業内容-(3)製品・開発パイプライン」を参照)
③「arfolitixorin(SP-05)」) の第III相国際共同臨床試験速報が公表
「arfolitixorin(SP-05)」) の第III相国際共同臨床試験速報が公表されたが、グローバルデータでの ORR(全奏効率:主要評価項目)及びPFS(無憎悪生存期間:副次評価項目)につき、arfolitixorin 併用群は標準療法群に対して統計学的に有意な改善を示さなかった。
(詳細は「会社概要-事業内容-(3)製品・開発パイプライン」を参照)
④中国自販体制を解消
22年7月、中国3大都市「北京市、上海市、広州市」における自販体制を解消した。
(解消の背景)
2019年に「Sancuso® (SP-01)」「エピシル® (SP-03)」の販売を開始したが、2020年初頭に武漢で発生した新型コロナウィルス感染症拡大の影響(ロックダウン)により販売開始スタートダッシュ及びその後の規模拡大が制約を受けた。
上海市がん診療大型病院全37施設中、30施設が入院外来とも閉鎖となり、残る施設もほぼ手術入院患者のみの対応となった。このため、MRの病院訪問機会は減少し、がん治療受診患者も減少した。
このため、3都市における病院/薬局に対する2022年1月~6月の出荷数量は、「Sancuso® (SP-01)」で前年同期比8%減、「エピシル® (SP-03)」で同33%減となり、現在は回復傾向にあるものの、売上高当初想定に比べて低調に推移しており、自販体制維持が経常的な赤字計上の主要因となっていた。
(今後の対応)
8月以降の3都市における「Sancuso® (SP-01)」および「エピシル® (SP-03)」の販売活動は、中国の他地域同様にLees Pharmに移管した。ソレイジア・ファーマはLees Pharmに製品供給を行う。
自販体制解消により年間で10億円程度の固定費削減を図り、支出を伴う固定費を年額10億円程度とする体制を構築する。
連結従業員数は、77名(22年3月末)から28名に減少した。
⑤日本化薬株式会社との資本業務提携
22年7月、日本化薬株式会社と資本業務提携契約を締結した。
業務提携においては、ソレイジア・ファーマは日本化薬に対し、開発品導出機会に係る優先交渉権、製品及び開発品の製造に係る優先交渉権を付与した。
資本提携においては、日本化薬に対しソレイジア・ファーマ株式12百万株を第三者割当で発行し、10億20百万円を調達した。日本化薬は長期保有を前提としており、ソレイジア・ファーマは、日本化薬を開発・販売双方において有力なパートナーと位置付けている。
中国自社販売体制解消による10億円のコスト削減とこの約10億円の資金調達により、安定した財務基盤が構築できたとソレイジア・ファーマは考えている。
⑥伊藤忠商事株式会社との販売代理店契約が終了。保有株式の異動
22年9月、「Sancuso® (SP-01)」「エピシル® (SP-03)」の中国物流に関し伊藤忠商事との間で締結していた販売代理店契約が期間満了により終了した。
伊藤忠商事はソレイジア・ファーマ創業時からの株主であり、ソレイジア・ファーマは両製品の製剤製造国(欧米)から中国への輸出及び輸送、中国国内への輸入通関業務及び中国国内での流通体制構築において、伊藤忠商事の事業ノウハウを活用することで、物流体制を構築してきた。
そうした中、前述のように固定費削減を主目的とする自社販売体制解消を決定したことに伴い、両製品の販売はソレイジア・ファーマから直接 Lee’s Pharm社に対して行うこととなり、伊藤忠商事との販売代理店契約は22年 9 月 12 日の契約期間満了をもって終了することとなった。
こうした状況の下、伊藤忠商事によるソレイジア・ファーマ株式の保有関係について協議してきたが、伊藤忠商事より、伊藤忠商事の保有するソレイジア・ファーマ株式の内 630万株(発行済株式数の約4%)を、国内大手証券会社へ譲渡する予定である旨の連絡があった。伊藤忠商事は主要株主である筆頭株主から、筆頭株主に異動する予定。
また、ソレイジア・ファーマの荒井社長及び宮下取締役は、別途、伊藤忠商事持分の一部買取を検討している。
3.2022年12月期業績予想と今後の目標
(1)連結業績予想
|
|
21/12期 |
22/12期(予) |
|
売上収益 |
559 |
2,300~3,800 |
|
研究開発費 |
845 |
830~950 |
|
販管費 |
1,948 |
2,170~2,300 |
|
営業利益 |
-2,419 |
-1,100~150 |
|
税引前利益 |
-2,442 |
-1,100~150 |
|
当期利益 |
-2,478 |
-1,200~50 |
*単位:百万円。当期利益は親会社の所有者に帰属する当期利益。
販売収益と権利導出で黒字転換の可能性
◎売上収益
・「Sancuso® (SP-01)」の販売収益
・「ダルビアス® (SP-02)」の販売収益
・「ダルビアス® (SP-02)」の海外権利導出契約収入
・「エピシル® (SP-03)」の販売収益
・「arfolitixorin(SP-05)」の日本権利導出収入
◎研究開発費
・「ダルビアス® (SP-02)」の申請準備費用
・「ダルビアス® (SP-02)」の製造開発、中国開発費用
・「arfolitixorin(SP-05)」の第III相臨床試験費用
◎販管費
・市販後調査マーケティング活動費
・上市済製品無形資産償却費
(2)今後の目標
各パイプラインの目標実現のほか、パイプライン増強のため適切なタイミングで新規開発品の導入を実施し複数開発品のポートフォリオ構築を進めている。
2022年以降の目標は以下の通りである。
|
製品など |
2022年12月期以降の目標 |
|
|
「Sancuso® (SP-01)」 |
中国売上拡大(診療ガイドライン収載等のマーケティング諸活動)、製造施設変更(2024年) |
|
|
「ダルビアス® (SP-02)」 |
その他アジア地域での権利導出(2022年~)、適応症拡大開発・中国開発(2022年~)、米国・欧州・中国・その他地域での権利導出など(2022年~) |
|
|
「エピシル® (SP-03)」 |
中国・日本・韓国での売上拡大 |
|
|
「PledOx® (SP-04)」 |
非臨床動物試験結果により臨床試験実施(2022-) |
|
|
「arfolitixorin(SP-05)」 |
第Ⅲ相国際共同試験サブグループ解析等評価、戦略検討(2022~2023年) |
|
|
事業全般 |
研究開発費・償却費を除く営業利益黒字化達成、新規開発品導入 |
|
4.今後の注目点
22年8月、「arfolitixorin (SP-05)」の第Ⅲ相臨床試験のトップライン速報結果が公表されたが、残念ながら、グローバルデータでの ORR(全奏効率:主要評価項目)及びPFS(無憎悪生存期間:副次評価項目)につき、arfolitixorin 併用群は標準療法群に対して統計学的に有意な改善を示さなかったと公表された。
ただ、同社では「arfolitixorin (SP-05)」実用化の道筋は十分あると考えている。
今後は、対象を日本人患者に絞ったサブグループ解析、更新PFS解析、OS解析(全生存期間)等の追加解析の結果をIsofol社と共同で見極めていくが、例えば日本人での解析結果が速めに明らかになりポジティブであれば今期中若しくは来期前半の導出契約成立、金契約金収受の可能性もあるとのことで、追加解析の結果を待ちたい。
また、予定通り3番目の製品実用化となった「ダルビアス® (SP-02)」の日本における販売状況、海外における導出についても進捗を注目していきたい。
<参考:コーポレートガバナンスについて>
◎組織形態、取締役、監査役の構成
|
組織形態 |
監査役設置会社 |
|
取締役 |
5名、うち社外3名 |
|
監査役 |
3名、うち社外3名 |
◎コーポレートガバナンス報告書
最終更新日:2022年3月28日
<基本的な考え方>
当社は、医薬品開発企業としての事業活動を通じ、患者をはじめとする医療現場に貢献することが当社の使命と考えています。また、これらの事業活動を通じて、企業価値の向上と株主への利益還元を図り、ステークホルダーに対して説明責任を果たすことは、当社の使命を達成するための重要な事象であると認識しています。このため、当社は、経営の「遵法性」「透明性」を確保しつつ、社外取締役の監視・監督と監査役の監査体制を充実させることにより、コーポレートガバナンス(企業統治)を有効に機能させることを基本方針としています。
<実施しない主な原則とその理由>
「当社は、コーポレートガバナンス・コードの基本原則をすべて実施しています。」と記載している。

