(2183) 株式会社リニカル グローバル化による業績拡大
|
 秦野 和浩 社長 |
株式会社リニカル(2183) |
|
 |
会社情報
|
市場 |
東証1部 |
|
業種 |
サービス業 |
|
代表取締役社長 |
秦野 和浩 |
|
所在地 |
大阪市淀川区宮原1-6-1 新大阪ブリックビル |
|
決算月 |
3月 |
|
HP |
株式情報
|
株価 |
発行済株式数(自己株式を控除) |
時価総額 |
ROE(実) |
売買単位 |
|
|
697円 |
22,586,436株 |
15,742百万円 |
9.8% |
100株 |
|
|
DPS(予) |
配当利回り(予) |
EPS(予) |
PER(予) |
BPS(実) |
PBR(実) |
|
14.00円 |
2.0% |
-円 |
-倍 |
268.20円 |
2.6倍 |
*株価は3/4終値。発行済株式数は直近四半期末の発行済株式数から自己株式を控除。
*ROEは21/3月期。DPSは22/3月期予想。EPSは非公表。数値は四捨五入。
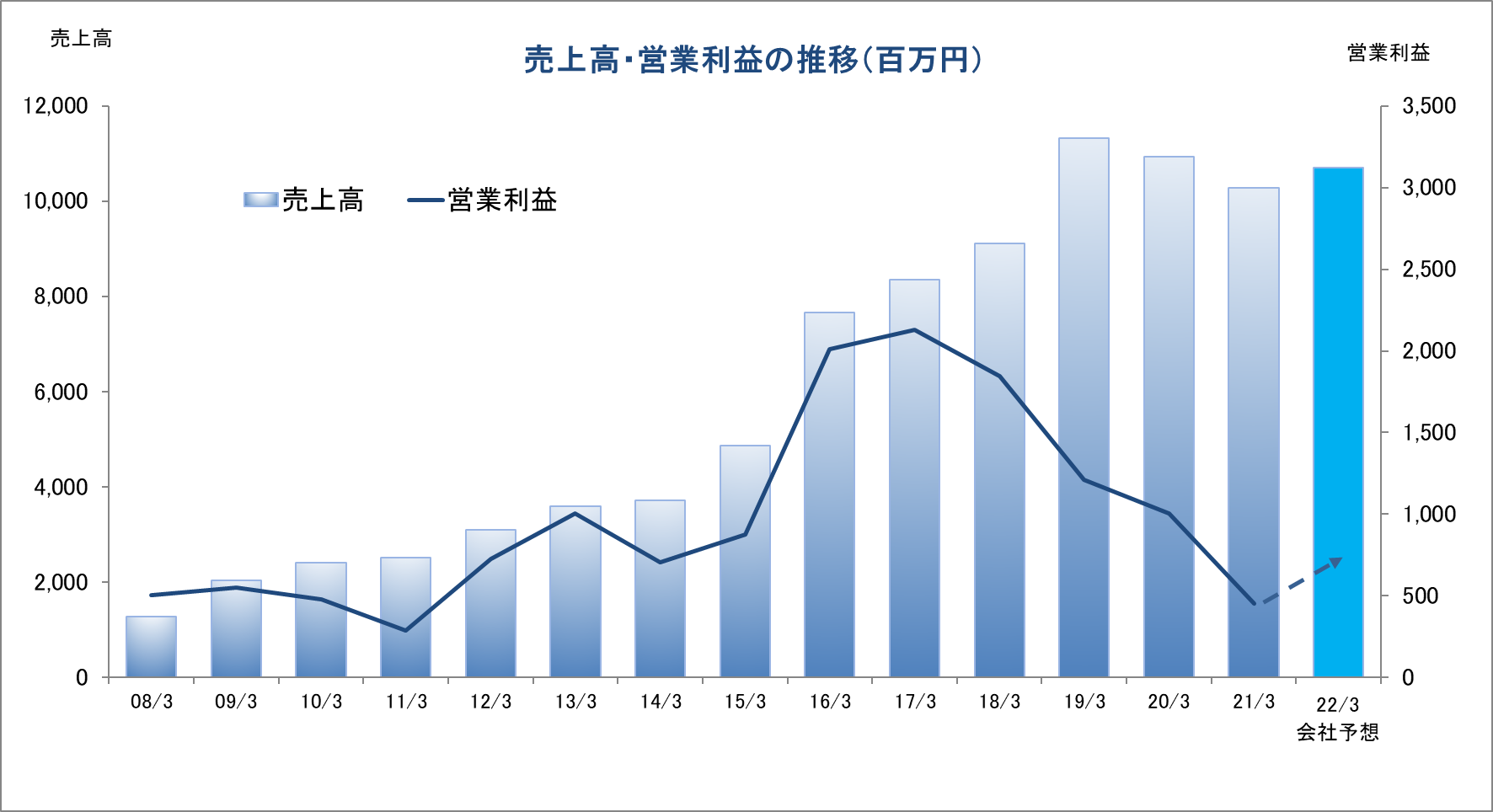
連結業績推移
|
決算期 |
売上高 |
営業利益 |
経常利益 |
親会社株主帰属利益 |
EPS |
DPS |
|
2018年3月(実) |
9,113 |
1,846 |
1,826 |
1,295 |
57.02 |
11.00 |
|
2019年3月(実) |
11,313 |
1,212 |
1,253 |
568 |
25.09 |
12.00 |
|
2020年3月(実) |
10,935 |
1,005 |
918 |
482 |
21.38 |
14.00 |
|
2021年3月(実) |
10,279 |
453 |
588 |
539 |
23.91 |
14.00 |
|
2022年3月(予) |
10,700 |
683 |
– |
– |
– |
14.00 |
*予想は会社予想。
*経常利益と親会社株主に帰属する当期純利益の連結業績予想は、為替相場の変動など未確定な要素が多く非公表。
リニカルの2022年3月期第3四半期決算概要について、ブリッジレポートにてご報告致します。
目次
今回のポイント
1.会社概要
2.経営戦略
3.2022年3月期第3四半期決算
4.2022年3月期業績予想
5.今後の注目点
<参考:コーポレート・ガバナンスについて>
今回のポイント
- 22/3期第3四半期は前年同期比14.4%の増収、302.9%の営業増益。経済活動の改善傾向が続いた欧米地域において既存の受注案件を順調に消化し業績が拡大した。加えて、回復が遅れていた日本においても上半期の受注活動の成果が売上高に貢献し始めたことなどにより業績の回復傾向が強まった。米国では売上高と営業利益が、欧州でも売上高が第3四半期連結累計期間として過去最高を記録した。
- 22/3期の会社計画は、前期比4.1%の増収、同50.6%の営業増益の予想から修正なし。期初想定通り、新型コロナの影響が残るものの、日本・アジア地域は今第4四半期から、欧州は今第3四半期から、米国は今第2四半期から業績が正常化する見込み。こうした環境下、同社グループはグローバル化を推し進め、既存のCROとの差別化を図る方針である。また、配当も前期と同額の1株当たり普通配当14円の予想を据え置き。
- 同社の受注環境が好転している。米国では良好な取引関係にある米国バイオテック企業等から複数の新規案件の打診を受け、契約に向けた交渉を行っている。加えて、欧州でも複数の大型案件を含む新規案件の打診を受けている他、 日本・アジアでも新規案件の引き合いが増加している。来期以降の業績拡大のドライバーとなるグローバル規模での大口受注を獲得できるのか注目される。
1.会社概要
臨床試験(治験)に関わる業務の一部を代行する事で製薬会社の医薬品開発を支援するCRO(Contract Research Organization)事業を中心に、医薬品のマーケティング業務ならびに製造販売後(以下製販後という)臨床研究・調査の受託などを行う育薬事業を手掛ける。
医薬品は発売前に厚生労働省の承認・認可を受けることが義務づけられており、承認前の薬剤(医薬品候補)を患者に投与して効果や安全性を確かめる必要がある。その臨床試験としての治験を支援する事業がCRO(Contract Research Organization)である。また、医薬品は製販後も調査、臨床研究を行う必要があり、その段階を支援する事業が育薬(Contract Medical Affairs)である。
同社は創業以来、がん・中枢神経系(CNS)など、世界中の人々がその撲滅を願い、新薬開発への強いニーズが存在する疾病領域を中心にCRO事業を展開してきた。これらは非常に難易度が高い領域であり、同社の知識・経験豊富なエキスパートが高度な治験を支えている。また、同社は創薬支援・育薬事業にも力を注ぎ、申請業務支援、承認後のマーケティングや臨床研究、製販後調査支援まで、単なるアウトソーシングを越えてお客様の事業を幅広くコンサルティングする「製薬会社の真のClinical Development Partner(医薬品開発パートナー)」を目指している。更に、国際化・大規模化が進む医薬品開発の流れのなかで、グローバルで大規模なプロジェクトにも同社グループのワンストップで十分な対応を行い、製薬会社とともに新しい時代を開拓していく戦略的ビジネスパートナーとして、顧客の市場競争力の拡充をトータルに支援している。
また、同社は、受託特化型の事業形態により、特定業務への特化(治験の主要業務であるモニタリング業務、品質管理業務、コンサルティング業務)、特定治験段階への特化(フェーズⅡ、フェーズⅢ)、特定顧客への特化(豊富な医療品開発情報を有する大手製薬会社)を通じて、高収益体質を構築している。
【沿革】
2005年6月、藤沢薬品工業株式会社(現 アステラス製薬株式会社)で免疫抑制剤等の開発に携わってきたメンバー9名によって設立された。大阪発理想の医薬品開発受託(CRO)事業を目的として、設立当初から、CNS領域やがん領域の育成に取り組み、会社設立後まもなく大塚製薬からCNS領域の案件を受注。その後、人材を補強し事業部として受注活動を強化した。また、がん領域も外資系製薬会社等でがん領域の医薬品開発を手掛けた人材等に恵まれ、足元、受注が拡大している。
SMO(治験施設支援機関)事業進出を念頭に、06年1月に同事業を手掛けるアウローラ(株)を子会社化したが、CRO事業への経営資源集中を図るべく07年5月に全保有株式を売却。08年7月に、国内の製薬会社の米国進出支援を目的に米国カリフォルニア州に全額出資子会社LINICAL USA, INC.を設立。同年10月の東証マザーズ上場を経て、13年3月に東証1部に市場変更となった。13年5月に、台湾と韓国に全額出資子会社LINICAL TAIWAN CO., LTD.とLINICAL KOREA CO., LTD.を設立。14年4月には、LINICAL KOREA CO., LTD.と買収した韓国のCROであるP-pro. Korea Co., Ltd.との統合を完了した。14年10月29日には欧州でCRO事業を展開しているNuvisan CDD Holding GmbHの全株式を取得し子会社化するための株式譲渡契約を、Nuvisan Pharma Holding GmbH との間で締結し、12月1日付けで同社の100%子会社となった。更に、グループとしての一体感の醸成と連携強化を図るため、連結子会社となったNuvisan CDD Germany GmbHの名称をLINICAL Europe GmbHに商号変更した。その他、16年3月にLINICAL U.K. LTD.を、同年10月にLINICAL POLAND Sp.z.o.o.を、17年9月にLINICAL Czech Republic s.r.oを 設立した。また、2018年4月に米国でAccelovance, Inc.を買収し、Linical Accelovance America, Inc.に社名変更。その他、19年3月にLinical Hungary Kft.を設立、19年5月にLinical China Co., Ltd.を設立した。更に、2019年12月にLINICAL Europe GmbHへLAA社の欧州子会社を統合し欧州地域の強化を図ったことに加え、20年2月に上海支店を開設し国際共同治験の受託体制が更に強化された。また、20年4月にLinical Benelux B.V と Linical Accelovance Europe B.V. を合併し、Linical Netherlands B.Vを発足、23年3月期にはLinical China Co., Ltd. とLinical Accelovance China Ltd.の統合を予定している。
【業務内容】
同社は、主にCRO事業(臨床開発事業)、製造販売後の臨床試験や臨床研究とマーケティング活動支援を担当する育薬事業、創薬支援事業を展開している。非臨床試験段階から臨床開発、製造販売後の育薬まで一気通貫で対応出来る体制をとることで、効率的な新薬開発による上市までの期間の短縮や製品ライフサイクルの延長を可能とし、製薬会社の真のパートナーとして医薬品の価値最大化に貢献している。更に、同社は、製薬会社のみならずバイオベンチャーに対して、ライセンス等の出口戦略まで多面的に支援している。
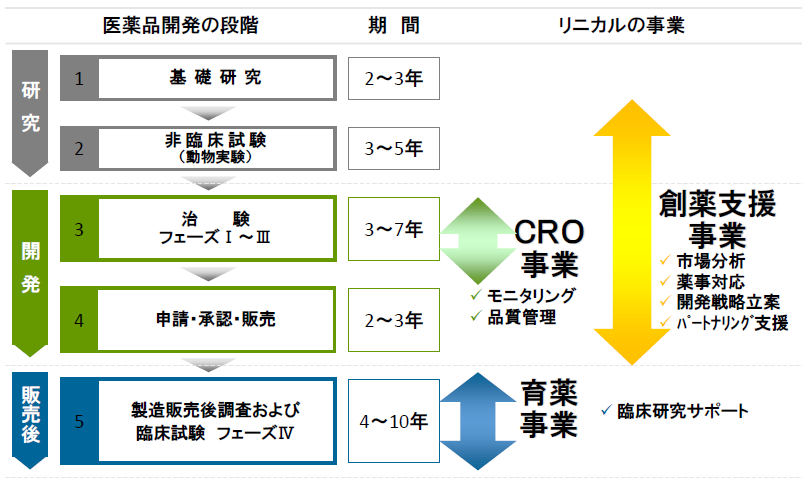
(同社決算説明会資料より)
CRO事業(臨床開発事業)
主力のCRO事業においては、事業特化型CROに特徴がある。新薬の迅速な市場投入につながる高品質で高効率な治験の支援を目指して、高い技術と豊富な経験をもつスタッフが担当にあたっている。今後も拡大するグローバルスタディに対応していくため、アジア(韓国、台湾、シンガポール、中国など)と欧州、米国に拠点を開設。薬事から企画、実施計画書の作成、モニタリング、データマネージメント、統計解析、ファーマコビジランスまでワンストップで対応。国際共同治験においては、リニカル本社を窓口に位置づけ、各国に医薬品開発事情に精通した人材を配置。日本語ベースで機動的な国際共同治験が可能な開発環境を整えている。10年から20年近くに及ぶ新薬開発プロジェクトの中でも、3年から7年を要するといわれる治験で特に重要とされる患者を対象とする「第Ⅱ相(フェーズⅡ試験)」「第Ⅲ相(フェーズⅢ試験)」のプロセスに特化し、受託特化型の事業形態にて治験の核となる「モニタリング」を「品質管理」「コンサルティング」とともに提供。信頼性の高いデータの収集を行い、迅速、確実な新薬開発の実現を支援している。更に、豊富な医薬品開発情報を有する大手製薬会社に特化すると共に、担当領域も市場からの開発要請の強いがん領域や中枢神経系領域をはじめ難易度の高い領域に特化することで、顧客である製薬会社のニーズに応えている。
また、同社は、スケジュール管理、治験標準業務手順書・GCP遵守、データ・症例報告書の信頼性などの分野におけるサービスクオリティの高さに強みを持っている。
*国際共同治験
「国際共同治験」とは、新規の医薬品開発に世界規模で取り組み、早期上市を目指すため、臨床試験を複数の国または地域において同時並行的に行うことをいう。
*GCP(Good Clinical Practice)
「GCP」とは治験を実施する際に守るべきルールで、日本で正しく治験を実施できるように厚生労働省により省令(法律を補う規則)として定められているもの。
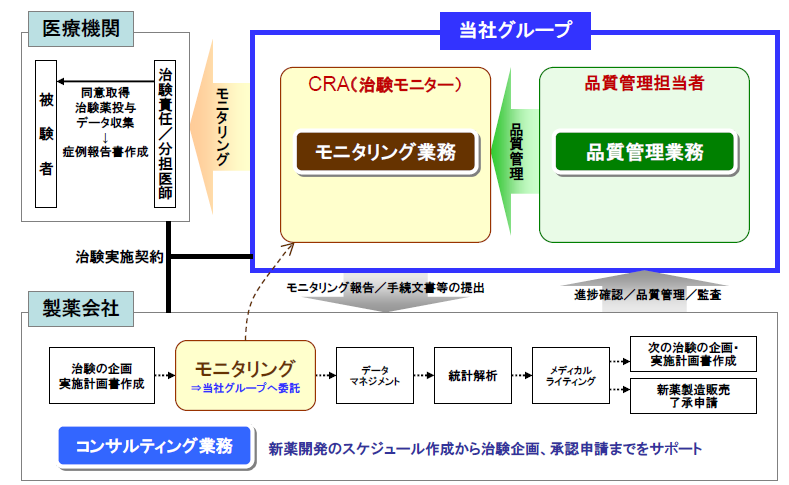
(同社決算説明会資料より)
育薬事業
臨床研究法が施行され臨床研究を取り巻く環境は大きく変化している中、情報をタイムリーにキャッチアップし、製薬会社のメディカルアフェアーズ部にとって最良のパートナーとなれるよう、臨床研究のモニタリング・研究事務局業務を中心にデータマネジメント・統計解析などを含めたフルサービスの支援を行っている。J-GCPだけでなく、倫理指針、臨床研究法に加えてICH-GCP準拠の臨床試験も対応しており、全てのレギュレーションでのサービスを提供している。また、当初よりPrimary領域、中枢神経領域でのサービスを提供。現在はがん領域を強化し、半数以上のモニターががん領域の経験者となっている。開発で培ったノウハウをベースに、最新のレギュレーションに対応し、難易度の高い領域でエビデンス創造に貢献する方針。
創薬支援事業
既存の臨床開発事業と育薬事業に続く、第3の事業である創薬支援事業 (Innovative Drug Development Business) を展開中。国内大手製薬会社でライセンス、事業開発、臨床開発、開発薬事、マーケティングといった業務に携わり、開発品の目利きから、導入・導出交渉、臨床開発などで数々の実績と豊富な経験を有している担当者が中心となり、主に①開発品の市場分析、②薬事相談のサポート、③ライセンスのサポートの3種のコンサルティングサービスを提供している。これらの経験を武器に、現在、国内または国外の製薬会社、バイオテクノロジーカンパニーからの業務を開発早期より支援している。今後、更に同社の国際拠点と連携し、グローバルでトータルにサポートできる体制を進める方針。
【5つの強み】
(1)グローバル規模でワンストップ
同社は日本発のグローバルCROとして、日本を中心にアジア、欧州、米国の3極でサービスを提供可能であり、同社として20ヶ国程度、パートナーを通じてサービスを提供出来る国を含めると30ヶ国程度においてサービスの提供が可能。また、医薬品開発のプランニングから、モニタリング、データマネジメント、統計解析、メディカル・ライティング、薬事、ファーマコ・ビジランスなどあらゆるサービスにおいて経験豊富なプロフェッショナル・メンバーが顧客ニーズに応え、Local試験はもちろん、マルチナショナル・トライアルまでフルサービス、且つ、ワンストップで提供している。
LINICAL Global 拠点 「日本・アジア+米国+欧州」の3極体制
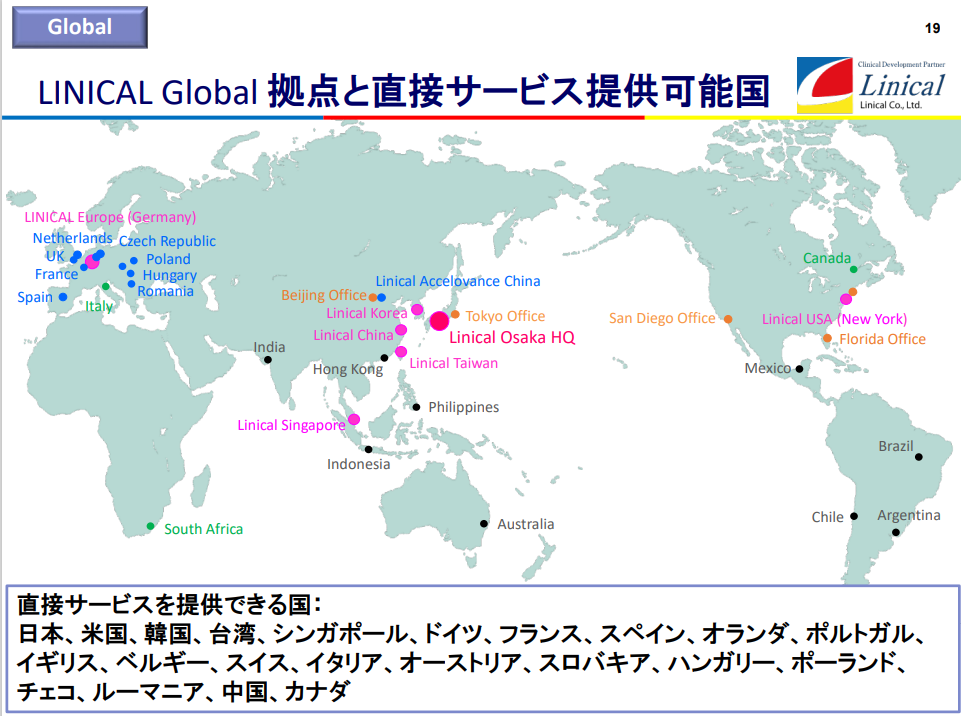
(同社決算説明会資料より)
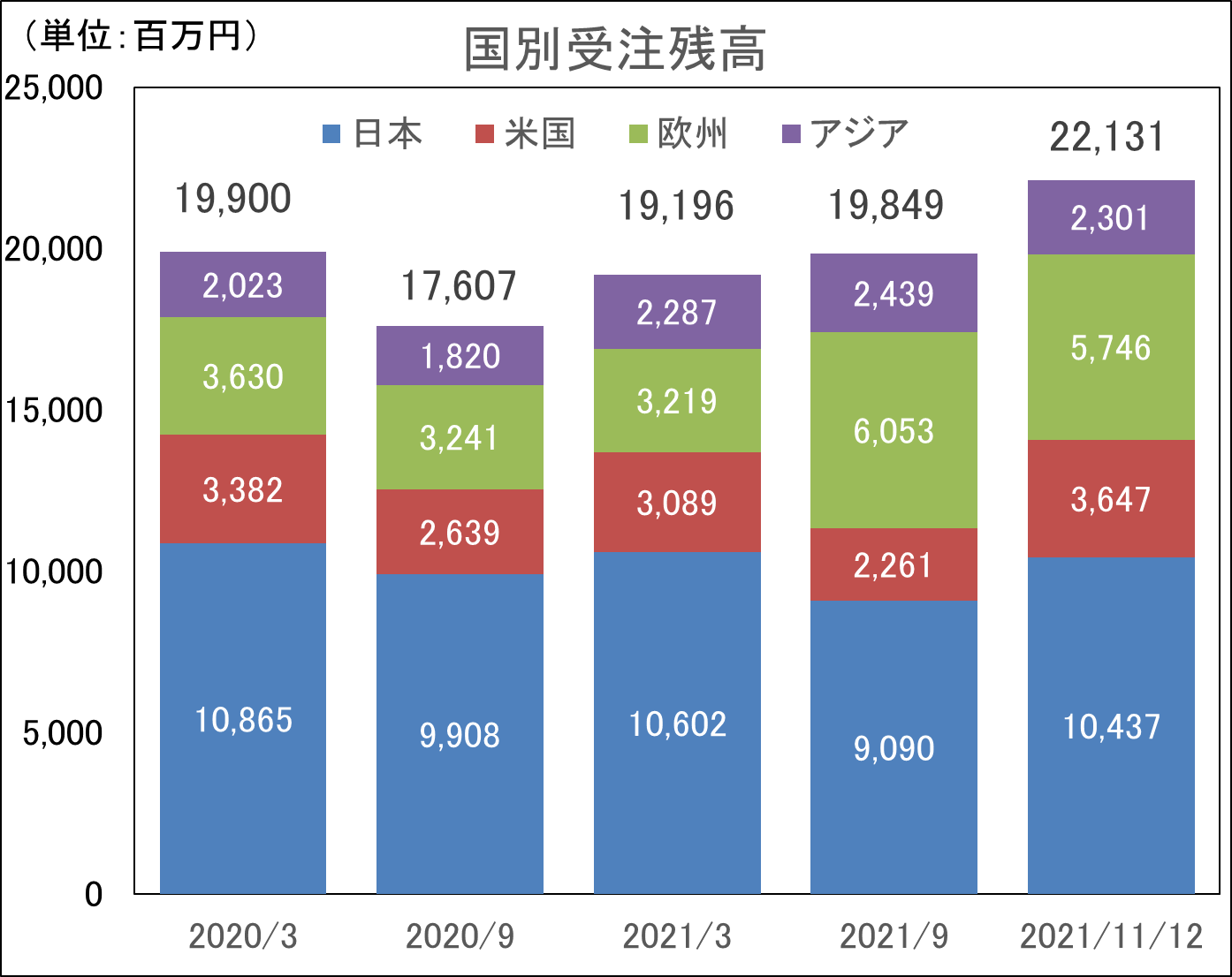
新型コロナウイルス感染症拡大の影響があるものの、日本・アジア+米国+欧州の3極体制整備の成果により、いずれの地域においても高水準の受注残高を維持している。また、21年11月12日時点の受注残高は、21/3期末より大幅に増加し220億円を上回り過去最高を記録した。
(2)創薬支援から臨床開発、臨床研究まで
同社はCSR(corporate social responsibility)として、医薬品開発業務の一端を担う会社として社会に貢献したいと考えている。更に、同社は顧客の真のパートナーとして薬剤の価値最大化に貢献するべく、創薬段階から臨床開発、製造販売後の育薬まで一気通貫で対応出来る体制をとることにより、効率的な新薬開発とライフサイクルマネジメントの延長を可能とし、上市までの期間の短縮(TTM)と売上の早期最大化(TTP)を図っている。日本においては創薬支援事業で創薬支援を、臨床開発事業(CRO事業)では臨床開発を、臨床研究支援事業では製造販売後の臨床試験や臨床研究をサポートしている。
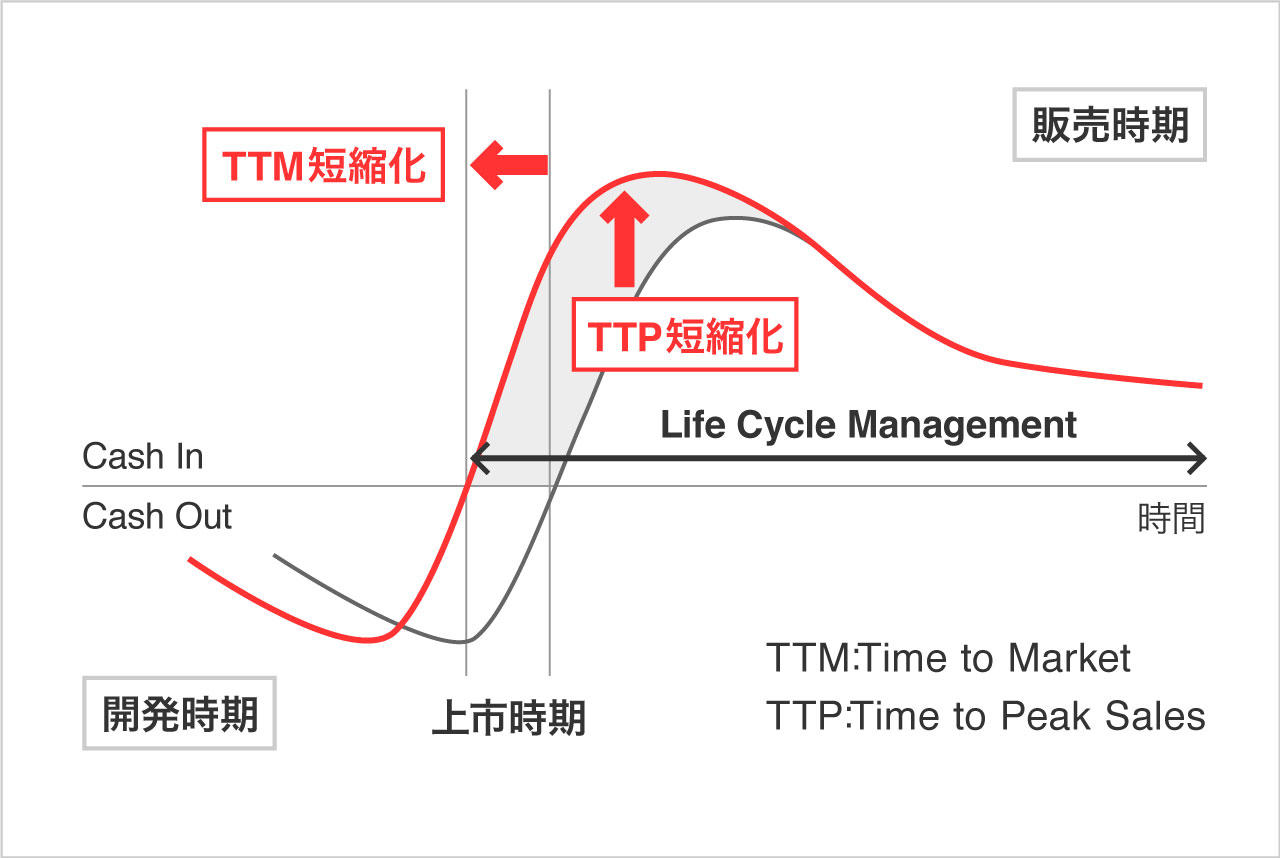
(同社HPより)
(3)がん・中枢・免疫にフォーカス
医薬品開発のトレンドは、がん、中枢神経系、免疫領域に集中してきている。同社創業メンバーは免疫領域において豊富な経験を持ち、創業当初より難易度の高い免疫領域等を中心にサービスを提供してきた。その後、日本においては2006年に中枢神経領域、2010年にがん領域へと専門性を拡げていき、現在では難易度の高い、がん、中枢神経系、免疫などアンメット・メディカル・ニーズな領域でのサービスを大きな3本柱として事業を展開している。また、海外子会社においても同じく、がん、中枢神経系、免疫系のサービス実績が多く、同社全体で難易度の高いがん、中枢神経系、免疫系を得意領域としている。更に、今後成長が見込まれる皮膚科領域や眼科領域に加え、難易度の高い再生医療領域も今後のサービスの大きな柱にするべく、準備を進めている。
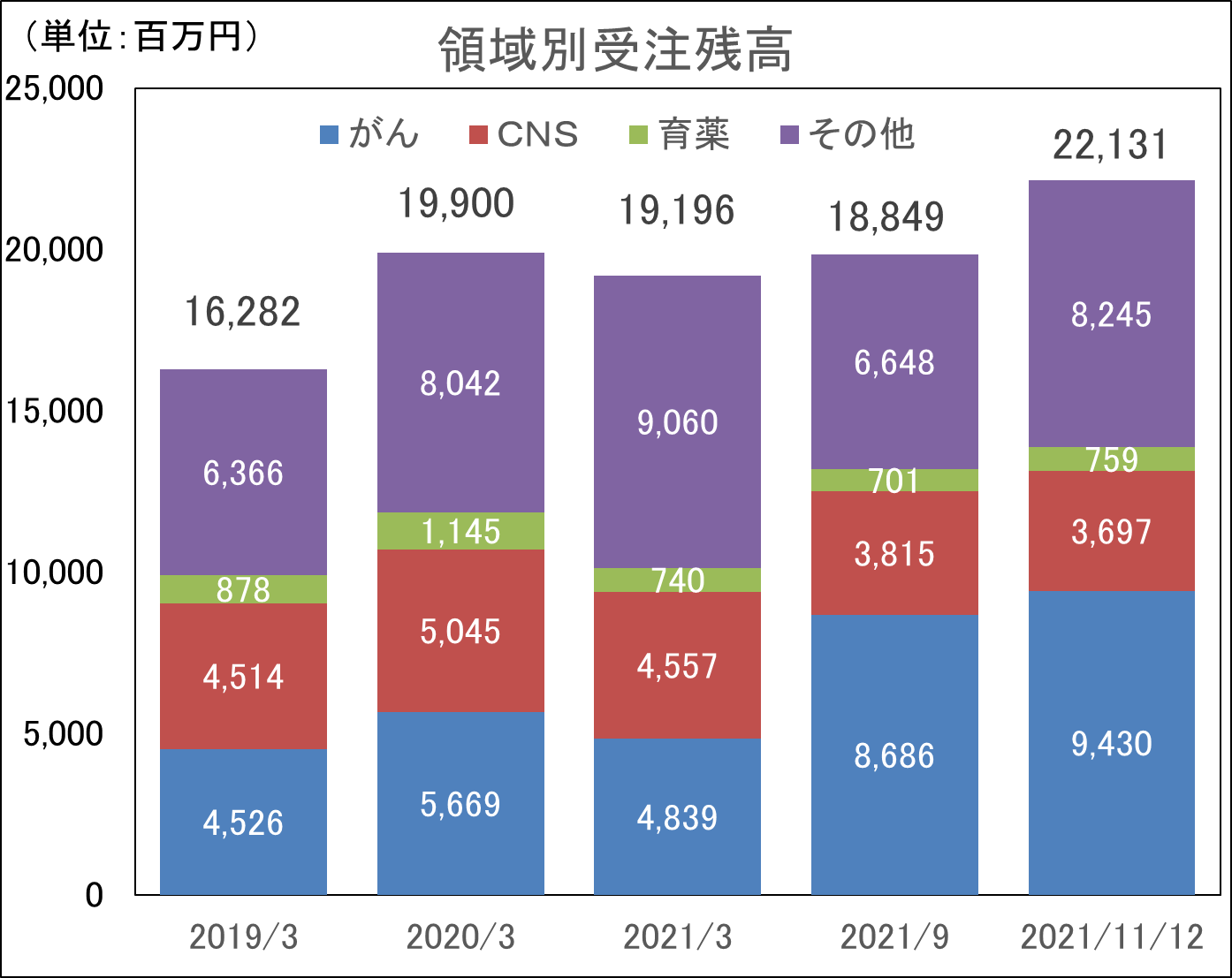
2021年11月12日時点の受注残高は過去最高水準にあるが、特にがん領域の拡大が著しい。
受託試験実績(2021年10月31日現在)
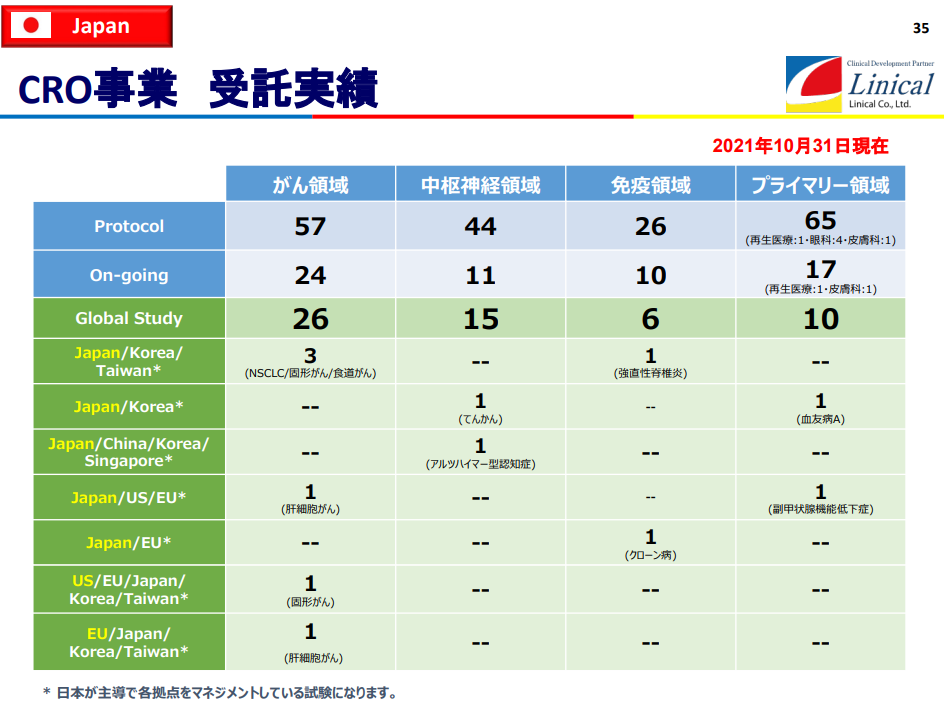
(同社決算説明会資料より)
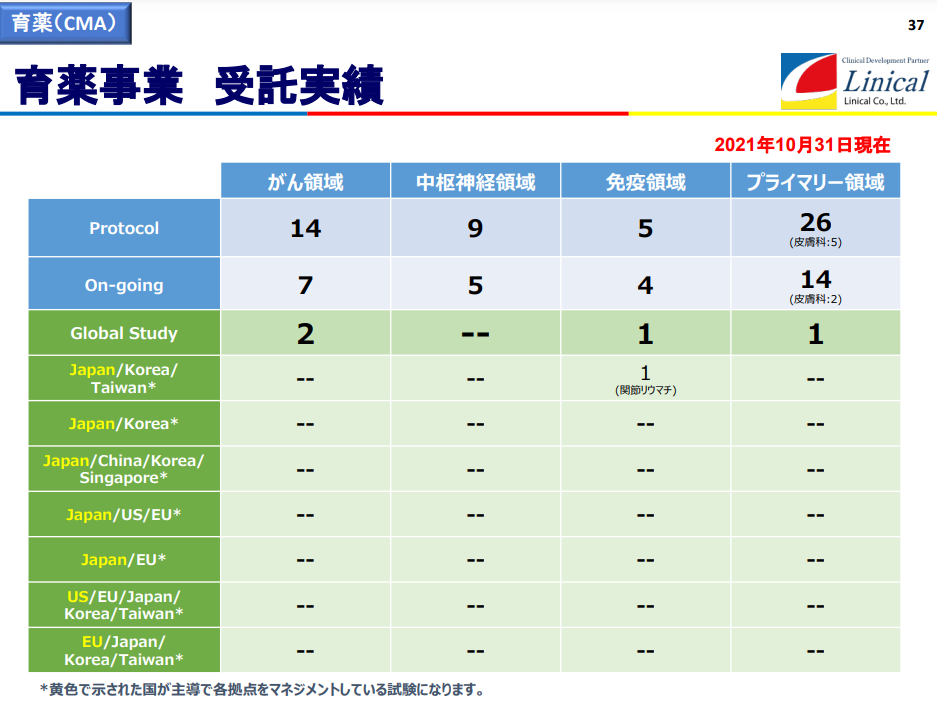
(同社決算説明会資料より)
(4)グローバル・コラボレーション
日本発グローバルCROとして、顧客へ世界規模のサービスを提供。高品質(Japan Quality)なサービスを提供する為に、日本に国際事業開発本部を設置し、日本語、英語、母国語を含めたその他言語(韓国語、中国語、ドイツ語など)が堪能なマルチリンガル・メンバーを大阪本社および東京支社に多数配置し、海外メンバーと適切なコミュニケーションをとっている。日本の顧客とは日本語でのコミュニケーションも可能。海外メンバーもJapan Qualityについて理解を深めており、All LinicalとしてJapan Qualityを提供している。
日本発の日台韓Asia試験の実施体制の一例として、日本にProject Managerを配置し、日台韓のLeaderを日本に配置するケース、各国拠点にLeaderを配置するケースなど、顧客ニーズに沿った提案があげられる。また、日本発の日米試験やEUとAsia、EUと米国との共同試験も多数実績があり、顧客の開発戦略に合わせた世界規模での提案が可能。
(5)高品質なサービス
同社は顧客へ高品質なサービスを提供すべく、社員に対して量・質ともに充実した教育を実施。その成果として、一般社団法人日本臨床試験学会による GCP サポート認定試験にて第 1 回目から高い合格率を維持しており、当学会より高い合格率と質の高い臨床試験の推進に貢献した証として感謝状を授与された。また、GCP 適合性調査の経験が豊富にあり、FDA inspectionの経験もある。いずれも適合・問題無しとの評価を受けており、同社の品質については社外からも高い評価を得ている。なお、海外子会社においても、FDA や KFDA 、ANVISA などからの inspection の経験があり、日本同様に高い評価を得ている。同社は、高品質とスピードを両立して最高のサービスを顧客に提供することが最大の使命と強く認識している。
2.経営戦略
日本の製薬会社は、画期的新薬の継続的創出とグローバル市場での承認取得・販売が不可欠となっており、様々な障壁を乗り越え、自社でグローバル開発・承認取得する必要性が高まっている。こうした環境下、日本の製薬会社は、M&Aを活用し米国、欧州、中国市場へ進出するか、日本発グローバルCROを活用し新薬の世界同時開発を目指す必要がある。
同社では、こうした製薬会社のニーズを満たすべく、グローバルの受託体制の整備を強力に推進している。
【第1目標】
①日本・アジア、欧州、米国での拠点整備、1000人体制の構築
②各極の黒字化
③世界20ヵ国程度への進出
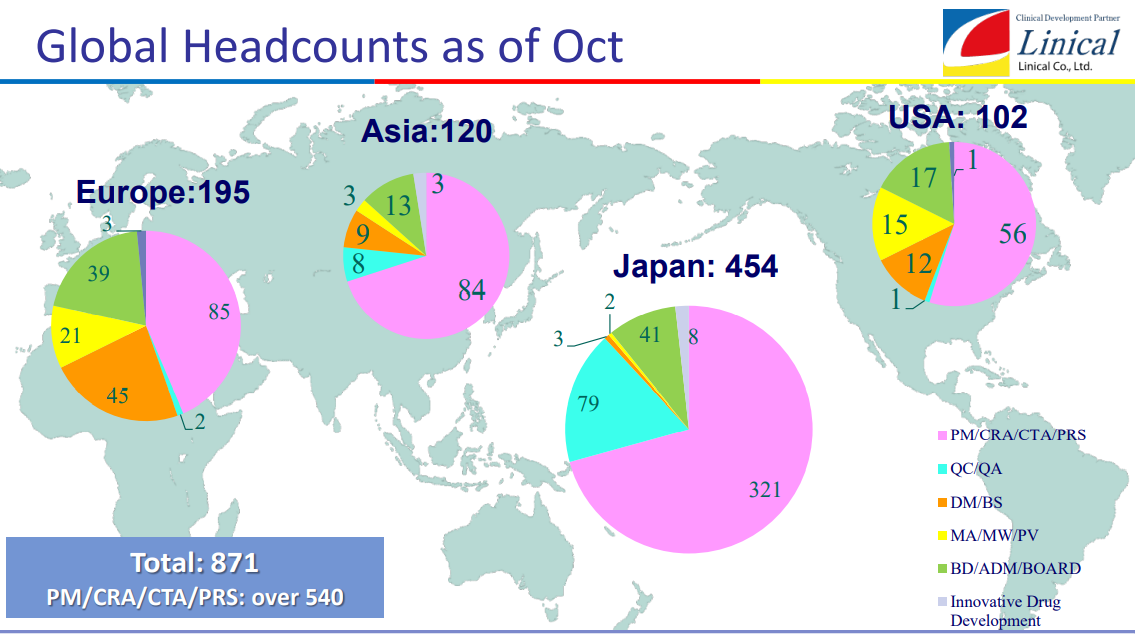
(同社決算説明会資料より)
【第2目標】
①日本500人、アジア400人、欧州400人、米国400、1500人を超える体制の構築
②各極で成長投資(M&Aを含む)を行いつつ黒字維持、利益率の向上
③世界60ヵ国程度への進出
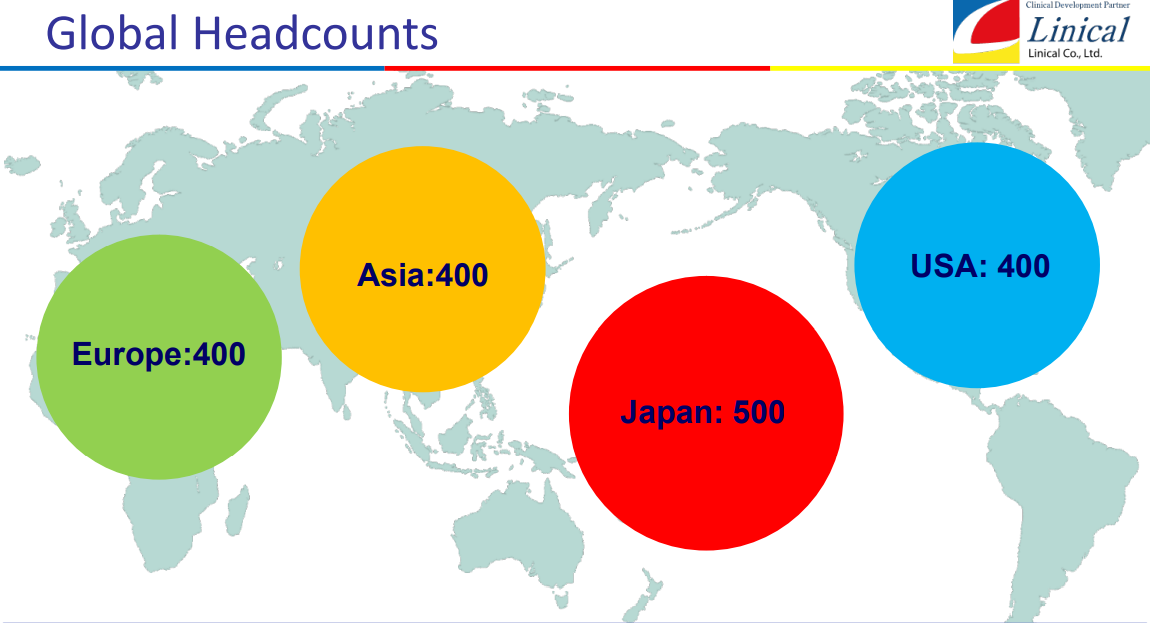
(同社決算説明会資料より)
(1)日本の戦略
【CRO事業】
|
|
初期 |
現在 |
|
顧客 |
国内大手製薬会社 |
国内大手製薬会社 海外大手製薬会社 国内外のバイオベンチャー |
|
疾患領域 |
がん領域 CNS領域 免疫領域 |
がん領域 CNS領域 免疫領域 眼科領域 皮膚科領域 再生医療 |
|
サービス |
モニタリング |
モニタリングプロジェクトマネジメント 品質管理/監査 データマネージメント メディカルライディング ファーマコビジランス など |
(同社決算説明会資料より)
従来は、国内大手製薬会社が中心であったが、フルサービスの提供を通じて海外大手製薬会社や国内外のバイオベンチャーにおけるシェアアップを図る。また、がん領域、CNS領域、免疫領域に加え、再生医療、皮膚科、眼科領域に本格的に進出する。
【育薬事業】
臨床研究法が施行され臨床研究を取り巻く環境は大きく変化しており、情報をタイムリーにキャッチアップし、製薬会社のメディカルアフェアーズ部にとって最良のパートナーとなれるよう、臨床研究のモニタリング・研究事務局業務を中心にデータマネジメント・統計解析などを含めたフルサービスの支援を行っている。J-GCPだけでなく、倫理指針、臨床研究法に加えてICH-GCP準拠の臨床試験も対応しており、全てのレギュレーションでのサービスの提供が可能である。また、当初よりPrimary領域、中枢神経領域でのサービスを提供していたものの、現在はがん領域を強化し、半数以上のモニターががん領域の経験者である。今後も開発で培ったノウハウをベースに、最新のレギュレーションに対応し、難易度の高い領域でエビデンス創造に貢献する方針である。
育薬事業の業績推移
|
|
12/3期 |
13/3期 |
14/3期 |
15/3期 |
16/3期 |
17/3期 |
18/3期 |
19/3期 |
20/3期 |
21/3期 |
|
売上高 |
138,400 |
169,226 |
288,205 |
364,918 |
553,399 |
806,764 |
908,810 |
954,438 |
1,032,353 |
949,335 |
|
営業利益 |
-21,016 |
19,504 |
68,010 |
111,006 |
208,284 |
293,028 |
277,848 |
263,702 |
368,393 |
247,600 |
*単位:千円
(注)16/3期第1四半期連結会計期間より従来のセグメントの名称を「CSO事業」から「育薬事業」へ変更した。
【創薬支援事業】
同社は、既存の臨床開発事業と育薬事業に続く、第3の事業である創薬支援事業 (Innovative Drug Development Business) を展開している。国内大手製薬会社でライセンス、事業開発、臨床開発、開発薬事、マーケティングといった業務に携わり、開発品の目利きから、導入・導出交渉、臨床開発などで数々の実績と豊富な経験をしている人材が中心となり、主に①開発品の市場分析、②薬事相談のサポート、③ライセンスのサポートの3種のコンサルティングサービスを提供している。
それらの経験をもとに、現在、日本、韓国、台湾の製薬会社、バイオテクノロジーカンパニーからの業務を開発早期より支援しており、今後、更に同社の国際拠点と連携し、グローバルでトータルにサポートできる体制を推進する方針である。
創薬支援事業 -3種のコンサルティング-
日本の医薬品市場に参入し、自社製品を流通・販売したいが、日本の市場や薬事の知識が十分でない、十分な開発・販売機能を備えていない、戦略的パートナー/ライセンシーを必要としている国内外のバイオテック・ベンチャー・カンパニー/中堅ファルマ対し、同社では以下のサービスを提供している。
|
市場分析/調査 |
・対象疾患の疫学調査 ・市場価値と動向予測 ・現行治療アルゴリズムとガイドライン調査 ・承認薬と開発パイプライン調査 ・目標とする製品性能(TPP)立案 ・公定薬価とピークセールス予測、収益性評価 |
|
薬事・ 開発戦略 PMDA相談 (MW) |
・開発/薬事戦略の立案と提案 ・PMDA相談のための資料作成、申し込み、会議出席、照会事項対応 ・治験薬概要書、プロトコル、同意文書等の作成 ・治験届と照会事項対応 ・治験国内管理人業務 ・オーファン薬の登録申請 ・Common Technical Document(CTD)作成 |
|
戦略的提携/ ライセンス |
・提携候補会社/ライセンシーの調査と分析 ・提携候補会社/ライセンシーとの面談、製品/技術の説明 ・パートナリング目的のカンファレンスへの参加 ・Due Diligenceのサポート ・契約交渉のサポート |
契約実績 – (2019年1月~2021年10月)
|
契約年 |
製品/技術 |
スポンサー 国籍 |
疾患領域 |
最も先行する国での 開発段階 |
契約サービス内容 |
||
|
市場分析 |
薬事/開発 戦略等 |
戦略的提携 /ライセンス |
|||||
|
2019年 |
低分子化合物 |
日本 |
皮膚疾患 |
申請準備中 |
|
● |
|
|
核酸 |
日本 |
炎症、感染症、眼疾患 |
非臨床 |
|
● |
|
|
|
低分子化合物 |
日本 |
神経痛 |
Phase I |
|
● |
|
|
|
モノクローナル抗体 |
日本 |
炎症性疾患 |
申請準備中 |
|
● |
|
|
|
低分子化合物 |
アイルランド |
消化器疾患 |
Phase II/Ⅲ |
|
●(ICCC) |
|
|
|
低分子化合物 |
カナダ |
神経変性疾患 |
Phase I/II |
● |
● |
|
|
|
2020年 |
低分子化合物 |
ドイツ |
神経内科 |
Phase I |
● |
● |
|
|
再生医療等製品 |
アメリカ |
眼疾患 |
申請準備中 |
● |
●(CTD) |
|
|
|
再生医療等製品 |
日本 |
心臓疾患 |
Phase I/II |
|
● |
|
|
|
モノクローナル抗体 |
日本 |
悪性腫瘍 |
Phase I/II |
|
● |
|
|
|
2021年 |
低分子化合物 |
韓国 |
眼疾患 |
非臨床 |
● |
|
|
|
低分子化合物 |
日本 |
中枢神経疾患 |
発売中 |
|
● |
|
|
|
モノクローナル抗体 |
ドイツ |
悪性腫瘍 |
発売中 |
|
● |
|
|
|
ポノクローナル抗体 |
日本 |
感染症 |
非臨床 |
|
● |
|
|
|
低分子化合物 |
日本 |
呼吸器疾患 |
発売中 |
|
● |
|
|
|
低分子化合物 |
日本 |
自己免疫性疾患 |
発売中 |
|
● |
|
|
|
低分子化合物 |
日本 |
神経痛 |
発売中 |
|
● |
|
|
|
低分子化合物 |
イギリス |
消化器疾患 |
Phase I |
|
|
● |
|
|
核酸 |
スウェーデン |
消化器疾患 |
Phase Ⅲ |
|
● |
|
|
●:サービス提供中 ●:サービス提供終了
ICCC: In-Country Clinical Caretaker (治験国内管理人)
CTD: Common Technical Document (医薬品の承認申請のための国際共通化資料)(同社決算説明資料より)
(2)アジアの戦略
21/3期の売上高9.2億円を早期に15億円まで拡大し、営業利益率15%を達成する。また、前期末の109名の人員を早期に200名まで拡大し、長期では自前の拡大にて400名体制を確立する。具体的な戦略としては、日本、欧州、米国の製薬会社による国際共同治験へのAsia地域の組入れを提案する。また、Asia地域のバイオテックによる日本、欧州、米国での開発需要の取込みを図る。加えて、中国市場の開拓進める。
(3)欧州の戦略
21/3期の売上高19百万EUROを早期に30百万EUROまで拡大し、営業利益率15%を達成する。また、前期末の191名の人員を早期に300名まで拡大し、長期では自前とM&Aも活用した拡大にて400名体制を確立する。具体的な戦略としては、がん、免疫疾患に加え、CNS領域を強化する。また、欧州系大手製薬会社、日系大手製薬会社との取引拡大に加え、有望バイオテック企業との取引を開拓し拡大する。更に、CROサービスとFSPモデルサービスの両輪で拡大目指す他、英国やイタリアでの拠点設立を検討する。
(4)米国の戦略
21/3期の売上高20.1百万USDを早期に30百万USDまで拡大し、営業利益率15%を達成する。また、前期末の98名の人員を早期に150名まで拡大し、長期ではM&Aも活用した拡大にて400名体制を確立する。具体的な戦略としては、がん、ワクチンから CNS、免疫等に領域を拡大する。また、日本大手製薬会社に加え、次のギリアドとなるようなバイオテック企業との取引開拓に注力し、顧客と二人三脚での成長を目指す。現在2社の有望バイオテックと良好な関係を構築しており、今後10社程度にまでの拡大を図る。加えて、カナダ、メキシコなどラテンアメリカ地域への展開を検討する。
3.2022年3月期第3四半期決算
(1)連結業績
|
|
21/3期 第3四半期 |
構成比 |
22/3期 第3四半期 |
構成比 |
前年同期比 |
|
売上高 |
7,532 |
100.0% |
8,613 |
100.0% |
+14.4% |
|
売上総利益 |
1,980 |
26.3% |
2,678 |
31.1% |
+35.3% |
|
販管費 |
1,772 |
23.5% |
1,842 |
21.4% |
+3.9% |
|
営業利益 |
207 |
2.8% |
836 |
9.7% |
+302.9% |
|
経常利益 |
107 |
1.4% |
846 |
9.8% |
+683.8% |
|
親会社株主に帰属する四半期純利益 |
157 |
2.1% |
524 |
6.1% |
+234.1% |
*単位:百万円
*数値には(株)インベストメントブリッジが参考値として算出した数値が含まれており、実際の数値と誤差が生じている場合があります。(以下同じ)
前年同期比14.4%の増収、同302.9%の営業増益
売上高は前年同期比14.4%増の86億13億円、営業利益は同302.9%増の8億36百万円。
同社グループは日本発のグローバルCROとして日亜米欧など18か国に展開しており、経営環境は、新型コロナウイルス感染症の状況やワクチン接種の進捗状況によって地域間で引き続き差異が生じている。同社では、期初において、新型コロナの影響が残るものの、日本・アジア地域は今第4四半期から、欧州は今第3四半期から、米国は今第2四半期から業績が正常化すると想定しており、現時点において当該想定に変更はない。こうした中、日本の復調や米国、欧州事業の業績が正常化したことにより、2021年10月以降、月次の連結売上高が10億円を超えるなど、業績の回復傾向が強まっている。売上高の回復に加え、売上総利益率が31.1%と前年同期比4.8ポイント上昇と収益性の向上も図られた。加えて、売上高対販管費率も21.4%と同2.1ポイント低下したことにより売上高営業利益率は9.7%(前年同期は2.8%)まで上昇した。また、営業外費用で前年同期に発生した1億29百万円の為替差損が今第3四半期は24百万円の為替差益に転じたことなどにより、経常利益は同683.8%の大幅増益となった。更に、親会社株主に帰属する四半期純利益は、Linical Accelovance America, Inc. (以下、LAA社)の前身であるAccelovance, Inc.が買収以前に受託していた案件に関する仲裁に関連する弁護士報酬や和解金の支払、サイバー攻撃に関連した対策費等が発生する一方、LAA社の売主との間で合併契約上の補償条項等に起因する紛争等に関し和解契約を締結し、エスクローから和解金を受け取ったことから5億24百万円(前年同期比234.1%増)となった。
米国での紛争については、同社の連結子会社であるLAA社とTopical Remedy, LLC等と和解契約を締結したことにより今後これに関連する費用の発生はなくなる。また、同社の連結子会社であるLinical USA, Inc. (以下「LUI社」)が、2018年4月に買収したAccelovance, Inc. (現Linical Accelovance America, Inc.)の売主との間で、合併契約上の補償条項等に起因する紛争等に関し、2021年11月3日、売主がLUI社に対して1,445,000ドルをエスクローから支払う旨の条項を含む和解契約を締結した。本件和解によってLUI社が受け取った1,445,000ドルについては、今第3四半期連結会計期間において特別利益に計上している。
なお、収益認識基準の適用により、売上高は1億41百万円増加し、営業利益と経常利益はそれぞれ17百万円減少している。
セグメント別売上高・利益
|
|
21/3期 第3四半期 |
構成比 |
22/3期 第3四半期 |
構成比 |
前年同期比 |
|
CRO事業 |
6,785 |
90.1% |
7,901 |
91.7% |
+16.5% |
|
育薬事業 |
747 |
9.9% |
711 |
8.3% |
-4.7% |
|
連結売上高 |
7,532 |
100.0% |
8,613 |
100.0% |
+14.4% |
|
CRO事業 |
1,157 |
86.2% |
1,856 |
88.9% |
+60.3% |
|
育薬事業 |
184 |
13.8% |
232 |
11.1% |
+25.7% |
|
調整額 |
-1,135 |
– |
-1,251 |
– |
– |
|
連結営業利益 |
207 |
2.8% |
836 |
9.7% |
+302.9% |
*単位:百万円
CRO事業は、日本の復調や米国、欧州事業の業績が正常化したことなどにより、売上高が79億1百万円と前年同期比16.5%増加し、セグメント利益は18億56百万円と同60.3%増加した。セグメント利益率は、23.5%と前年同期比6.4ポイント上昇した。
なお、収益認識に関する会計基準等の適用により、売上高は1億35百万円増加し、営業利益は17百万円減少している。
育薬事業は、前期において新型コロナウイルス感染症の影響及び開発案件の絞り込みなど製薬会社の開発計画の修正を受け、今期の売上に貢献する受注の獲得が低調であったものの、今期においては受注獲得が順調なことに加え、原価の発生を抑制したことにより、売上高が7億11百万円と前年同期比4.7%減少し、セグメント利益が2億32百万円と同25.7%増加した。セグメント利益率は、32.6%と同7.9ポイント上昇した。
なお、収益認識に関する会計基準等の適用により、売上高は6百万円増加し、営業利益に変更はなかった。
地域別業績動向
【日本】
日本は、上半期の受注活動の成果が売上に貢献し始めたことに加え、8月末からデルタ株の感染が減少を始め第3四半期中は小康を保ったことで、受注案件の消化が進んだこと等により10月以降、月次の業績が前年を上回って推移したことや、原価の発生を抑制した結果、売上高は前年同期を下回ったものの、営業利益は大幅な増益となった。
【アジア】
韓国は、ワクチン接種が進んだことから、治験環境が改善し、既存の受注案件を順調に消化したことや、今期獲得した複数案件が売上に貢献したことで、売上高、営業利益が第3四半期連結累計期間として過去最高を記録し、前年同期比で増収・営業増益となった。また、中国でもワクチン接種が進み、治験環境が引き続き改善していることから受注案件を順調に消化し、前年同期比で売上高は増収となったものの、先行的な人材投資等により営業利益は減益となった。一方、台湾は、新型コロナウイルス感染拡大により新規案件の獲得が進まなかったこと等の影響により、前年同期比で減収・営業赤字となった。
【欧州】
欧州は、同社の主要拠点国であるドイツ、フランス、スペイン等で米国同様に経済活動の改善傾向が続き、既存の受注案件を順調に消化し、さらに、複数の新規案件の売上貢献などにより売上高は第3四半期連結累計期間として過去最高を記録し、前年同期比で増収・営業増益となった。欧州事業では前期からの営業部門強化が大きな成果を出しており、日亜米欧で実施される大型グローバル案件等を含む複数案件の受注を獲得し、今期及び来期以降の売上に貢献する受注残高が大きく増加しており、イギリスなどを中心に先行的な人材投資等のコスト増加要因はあるものの、新型コロナウイルス流行前の成長・拡大路線に戻りつつある。
【米国】
米国は、7月以降デルタ株の感染が急速に拡大したものの、ワクチン接種が進んだことや重症化率/死亡率の低いオミクロン株への置換が進んだことなどにより経済活動の改善が継続し、既存の受注案件を順調に消化し、売上高、営業利益が第3四半期連結累計期間として過去最高を記録し、前年同期比で大幅な増収・営業増益となった。米国市場の新薬開発は旺盛であ
り、引き続き新規案件の受注に注力している。
(2)受注残高の推移
|
|
21/3期 期末 (A) |
22/3期 第3四半期末 |
22年2月14日現在 (B) |
前期末比 (B-A)/A |
|
中外製薬 |
3,351 |
4,165 |
4,039 |
+20.5% |
|
エーザイ |
2,926 |
4,107 |
4,010 |
+37.1% |
|
小野薬品工業 |
841 |
730 |
703 |
-16.4% |
|
その他 |
12,077 |
10,727 |
10,385 |
-14.0% |
|
受注残高合計 |
19,196 |
19,731 |
19,139 |
-0.3% |
*単位:百万円
同社のCRO事業において受託する治験業務では、1年から3年程度の治験実施期間において、症例数や対象疾患に起因する治験の難易度などにより受託総額が決定する。この実施期間についてクライアントと委受託契約を締結し、契約に従い売上が発生する。育薬事業においても、同程度の期間についてクライアントと委受託契約を締結し、契約に従い売上が発生する。
受注残高は、既に契約を締結済みの受託業務の受注金額の残高である。これは、今後1年から5年程度の期間で発生する売上高を示しており、同社グループの今後の業績予想の根拠である。
2022年2月14日時点の受注残高は、191億39百万円となった。米国は、現在良好な取引関係にある米国バイオテック企業等から複数の新規案件の打診を受け、契約に向けた交渉を行っている。欧州も前期からの営業部門強化が今期に大きな成果を出しており、日米欧で実施される大型グローバル案件等を含む複数案件の受注を獲得している。また、現在、複数の大型案件を含む新規案件の打診を受けており、来期以降の売上に貢献する受注の積み上げに向け、営業活動を活発化している。更に、日本・アジアも来期以降の売上に貢献する新規案件の引き合いが増加しており、受注獲得に向けた営業活動を活発化している。
(3)財政状態
財政状態
|
|
21年3月 |
21年12月 |
|
21年3月 |
21年12月 |
|
現預金 |
5,084 |
5,557 |
短期有利子負債 |
1,150 |
1,139 |
|
売上債権・契約資産 |
2,982 |
3,138 |
未払金・未払費用 |
1,120 |
1,091 |
|
立替金 |
1,183 |
950 |
前受金 |
1,909 |
2,092 |
|
流動資産 |
9,722 |
9,980 |
長期有利子負債 |
3,541 |
3,097 |
|
有形固定資産 |
701 |
660 |
負債 |
9,568 |
9,278 |
|
無形固定資産 |
3,651 |
3,470 |
純資産 |
5,712 |
6,057 |
|
投資その他 |
1,204 |
1,224 |
負債・純資産合計 |
15,280 |
15,336 |
|
固定資産 |
5,557 |
5,355 |
有利子負債合計 |
4,692 |
4,237 |
*単位:百万円
*有利子負債=借入金+リース債務
2021年12月末の総資産は前期末比55百万円増の153億36百万円。資産サイドは主に現預金、売上債権、投資有価証券などが増加要因となり、立替金、その他流動資産、のれんなどが減少要因となった。負債純資産サイドは、主に前受金、預り金、利益剰余金などが増加要因となり、未払法人税等、長期借入金などが減少要因となった。2021年12月末ののれんは、33億8百万円と前期末比1億55百万円減少。また、2021年12月末の自己資本比率は39.5%と前期末から2.1ポイント上昇した。
(4)新市場区分の上場維持基準の適合に向けた計画書
同社は、2022年4月に予定される株式会社東京証券取引所の市場区分の見直しに関して、2021年12月27日付でプライム市場を選択する申請書を提出した。一方、移行基準日時点(2021年6月30日)で、流通株式時価総額において当該市場の上場維持基準を充たしていないことから、上場維持基準の適合に向けた計画書を作成した。
具体的には、2023年3月期~2025年3月期の3か年で、中期経営計画に基づき (1) 収益力の強化、(2) コーポレートガバナンスの強化、(3) アカウンタビリティの強化を通じて、流通株式時価総額の増加を図る方針である。
【具体的な取組内容】
|
(1)収益力の強化 |
|
|
ターゲットとする顧客層の拡大 |
従来の日系大手製薬会社を中心とした顧客層を、海外大手製薬会社、国内外の バイオテックカンパニーまで拡大 |
|
ターゲットとする疾患領域の拡大 |
再生医療、細胞医薬、核酸医薬、治療アプリなど最新のモダリティを活用した治療法に対応することで、従来のがん・中枢・免疫領域を中心としたサービス提供から、 眼科、皮膚科、希少疾患等まで拡大 |
|
サービス領域の拡大 |
国内外の顧客に対する、市場分析、開発戦略策定、当局対応等のクライアントニーズにマッチしたコンサルティングサービスの強化により競合他社と差別化 |
|
海外事業の拡大 |
巨大医薬品市場である米国・欧州を重点戦略エリアとして営業を強化するとともに、 将来の更なるM&Aも視野に、海外事業の基盤強化・拡大を促進 |
|
財務基盤の強化 |
米国、欧州での更なるM&A等の大型成長投資に備え、有利子負債の圧縮を進め、 自己資本比率の改善を促進するとともに、自己株式の売却等による財務基盤の強化と成長投資資金の確保を検討 |
|
(2)コーポレートガバナンスの強化 |
|
|
経営の透明性・健全性の向上 |
経営の透明性・健全性をより 一層向上させるため、取締役に占める独立社外取締役比率の増加及び監査等委員会設置会社への移行等を積極的に検討 |
|
人材の戦略的多様化 |
女性、中途採用者、外国人など従業員の多様性を確保し、会社の持続的な成長に資する中核人材を育成するとともに、公平かつ生産性の向上につながる人事評価制度など人事関連諸制度について継続的に改善 |
|
(3)アカウンタビリティの強化 |
|
|
情報開示の充実 |
中長期的な企業価値の向上のため、情報開示の充実を継続的に推進するとともに、招集通知・その他の開示書類の英文化を推進 |
|
投資家との対話の推進 |
従来の機関投資家・アナリスト・個人投資家向けの決算説明会に加え、国内外の機関投資家との個別ミーティング等の対話機会をこれまで以上に促進 |
4.2022年3月期業績予想
(1)連結業績
|
|
21/3期 実績 |
構成比 |
22/3期 予想 |
構成比 |
前期比 |
|
売上高 |
10,279 |
100.0% |
10,700 |
100.0% |
+4.1% |
|
営業利益 |
453 |
4.4% |
683 |
6.4% |
+50.6% |
|
経常利益 |
588 |
5.7% |
- |
– |
– |
|
親会社に帰属する 当期純利益 |
539 |
5.3% |
- |
– |
– |
*単位:百万円
経常利益と親会社株主に帰属する当期純利益の連結業績予想は、為替相場の変動など未確定な要素が多く非公表。
前期比4.1%の増収、同50.6%の営業増益
第3四半期が終わり、22/3期の会社予想は、売上高が前期比4.1%増の107億円、営業利益が同50.6%増の6億83百万円の予想から修正なし。新型コロナの影響が残るものの、日本・アジア地域は今第4四半期から、欧州は今第3四半期から、米国は今第2四半期から業績が正常化する前提のもと、引き続き同社グループはグローバル化を推し進め、既存のCROとの差別化を図る方針である。
売上高営業利益率は、前期比2ポイント上昇の6.4%の見込み。経常利益と親会社株主に帰属する当期純利益の連結業績予想は、為替相場の変動など未確定な要素が多いことから非公表としている。
配当も前期と同額の1株当たり普通配当14円の予想を据え置き。
(2)各国の今後の経営展開
【今後の経営展開】
(利益確保の戦略)
|
日本 |
①Oncology、CNS、Immunologyに加え、再生医療、皮膚科、眼科領域に進出本格化 ②臨床研究法施行による企業主導臨床研究関連業務ニーズの取り込み ③創薬支援事業の拡大とCRO事業とのシナジーを高める ④グローバル体制確立によるグローバル試験の営業強化 |
|
アジア |
韓国、台湾に続き、中国ビジネスの拡充を進めアジア地域の利益貢献化を進める |
|
欧州 |
①競争力強化により利益率向上を目指す ②Linical EuropeとLinical Accelovance Europeの統合によるシナジーを加速 |
(投資戦略)
|
日本 |
Linical Australiaの設立検討 |
|
アジア |
①Linical ChinaとLinical Accelovance Chinaを統合し、規模拡大を検討 ②シンガポール事業を安定化 フィリピン、インドネシアなど人口の多いアジア地域への進出を検討 |
|
米国 |
①次の成長戦略の中心と位置づけ投資継続、400名体制を目指し、次のM&Aも検討 ②米国CRO市場の強さを反映し、PM採用を含む組織増強を継続 ③CNS領域を強化 Linical CANADAの設立検討、メキシコなどラテンアメリカへの進出を検討 |
|
欧州 |
①CNS領域を強化 ②最終的に400名体制構築のため自前or M&A活用を検討 ③Linical UKの増強とLinical Italy、Linical South Africaの設立検討 |
(3)のれんの残高と残存償却期間(2021/3期末)
|
|
金 額 |
残存償却期間 |
年間償却額※4 |
|
韓国 |
19/3期で償却終了 |
||
|
欧州 ※1、2 |
1,378 |
12-13年 |
107 |
|
米国 ※1,3 |
2,084 |
13年 |
152 |
※1 Linical Accelovance America, Inc. Inc.(以下、 LAA )買収により発生したのれんについて、その欧州子会社分をEUROREに按分。
※2 のれん以外にPurchase Price Allocationにより認識された無形固定資産の21/3期末残高は91百万円。これらの残存償却期間は6~10年。
※3 のれん以外にPurchase Price Allocationにより認識された無形固定資産の21/3期末残高は50百万円。これらの残存償却期間は6年。
※4 105円/ドル、125円/ユーロで換算した数値。
(4)通期業績予想に対する第3四半期実績の進捗状況
|
|
22/3期 第3四半期 |
22/3期 通期会社予想 |
進捗率 |
|
売上高 |
8,613 |
10,700 |
80.5% |
|
営業利益 |
836 |
683 |
122.5% |
*単位:百万円。
22/3期第3四半期累計期間は、通期の会社計画に対して売上高で80.5%、営業利益で122.5%の進捗率となっている。22年2月14日時点で191億円を超える高水準の受注残高を抱えており、会社計画の大幅超過が期待される。
(5)抗アルツハイマー型認知症(AD)薬臨床試験受託の拡大
アルツハイマー型認知症(AD)患者はすべての認知症患者の6~7割を占め、全世界で約4,900万人、日本で560万人と推定され、治療満足度及び薬剤貢献度がともに最も低い。また、いまだに治療法が見つかっていない疾患であり、新薬開発に対する医療ニーズも大きい。ADを標的とする開発化合物は126品目、臨床試験は152試験が実施されており(2021年1月5日時点)、うち8割はアルツハイマー型認知症の病態の本質的な過程に作用して疾患の進行を抑制する”疾患修飾療法”(DMT:Disease-modifying therapeutics)である。2021年6月7日(現地時間)に、DMTとして世界で初めてアデュカヌマブ(バイオジェン・エーザイ)がFDAに承認され、米国でADの新薬が承認になるのは18年ぶりとなる。アデュカヌマブの対象は軽度認知障害(MCI)患者から早期AD患者であるが、極めて早期のAD(プレクリニカルAD)患者にDMTを予防的に適用し、発症時期を遅らせる治療アプローチが既にスタートしている。
同社はこれまで、抗アルツハイマー型認知症(AD)薬の臨床試験を複数受託している。こうした、受託実績を武器に今後抗AD薬の臨床試験の大型受託の獲得を目指す方針である。
【開発中の抗AD薬(2021年1月時点)】
|
フェーズ |
開発化合物数 |
試験数 |
備考 |
|
Ⅲ |
28(17) |
41 |
Aducanumab (Biogen-Eisai), Brexpiprazole (Otsuka), Gantenerumab (RocheChugai), Lecanemab/BAN2401 (Eisai), Solanezumab (Eli Lilly), Troriluzole(Biohaven pharma) |
|
Ⅱ |
74(64) |
87 |
ACI-35 (AC Immune-Janssen), AL002 (Alector-AbbVie), Donanemab/LY3002813 (Eli Lilly), Edonerpic/T-817MA (Toyama kagaku), Gosuranemab/BIIB092 (Biogen), MAPTRx/BIIB080 (Ionis), JNJ-63733657 (Janssen), RO7126209/BS-Gante (Roche), Semorinemab/RO7105705 (Roche), Tilavonemab/ABBV-8E12 (AbbVie), Zagotenemab/LY3303560 (Eli Lilly) |
|
Ⅰ |
24(23) |
24 |
Edicotinib/JNJ-40346527 (Janssen), Lu AF87908 (Lundbeck), LY3372993 (Eli Lilly), MK-1942 + donepezil (Merck), MK-4334 (Merck) |
|
合計 |
126(104) |
152 |
|
(同社決算説明会資料より)
*カッコ内は疾患修飾療法薬、青字はDMT
【同社の抗AD薬臨床試験受託実績(2012年~現在)】
|
フェーズ |
開発化合物数 |
試験数 |
備考 |
|
Ⅳ(育薬) |
該当せず |
4 |
ADの新規スケール作成から検証及び実証 |
|
Ⅲ |
2 |
6 |
いずれも継続試験進行中 |
|
Ⅱ |
3 |
3 |
いずれも完了 |
|
Ⅰ |
1 |
2 |
いずれも完了 |
|
合計 |
6 |
15 |
|
(同社決算説明会資料よ
5.今後の注目点
22/3期第3四半期(10-12月)の売上高は30億91百万円となり、2021年10月以降、月次の連結売上高が10億円を超えるまで業績が回復している。米国、欧州、韓国では第3四半期累計期間(4-12月)において過去最高の売上高となった他、回復が遅れていた日本においても昨年10月以降月次の業績が前年を上回るまで回復している。こうした中、同社の第3四半期累計期間の営業利益は、通期の会社計画の営業利益である6億83百万円を1億53百万円上回る着地となった。しかし、新型コロナウイルス感染症の再拡大や先行投資負担の増加などを考慮し、通期の会社計画は売上高、営業利益ともに上方修正が見送られた。22年2月14日時点における191億円を超える高水準の受注残高の順調な消化を通じて、今期業績をどこまで積み上げることができるのか注目される。また、来期の業績拡大につながる受注についても、米国において良好な取引関係にある米国バイオテック企業等から複数の新規案件の打診を受け、契約に向けた交渉を行っている。加えて、欧州でも複数の大型案件を含む新規案件の打診を受けている他、日本・アジアでも新規案件の引き合いが増加している。今後どれ位の規模の大型受注を獲得することができるのか、期末時点でどれ位まで受注残高を積み上げることができるのか注目される。
更に、現在同社は残念ながら流通株式時価総額においてプライム市場の上場維持基準を充たせていない。新たに作成した新市場区分の上場維持基準の適合に向けた計画書に基づき、今後流通株式時価総額の拡大に向けた取組が本格化するものと期待される。流通株式時価総額の拡大には、流通株式数の増加という手段があるものの株価の上昇も大きな影響を及ぼす。同社では、株価上昇に向けてこれまで以上に収益力の強化とコートレート・ガバナンスの強化とアカウンタビリティの強化に取り組む方針である。中でもアカウンタビリティの強化では、英文開示を含めた開示情報の充実やこれまで以上の投資家との対話の充実が予定されている。流通株式時価総額の拡大に向けた取組の成果にも期待を込めて注目して行きたい。
<参考:コーポレート・ガバナンスについて>
◎組織形態および取締役・監査役の構成
|
組織形態 |
監査役設置会社 |
|
取締役 |
9名、うち社外2名 |
|
監査役 |
3名、全員社外監査役 |
◎コーポレート・ガバナンス報告書
最終更新日:2021年12月28日
コーポレート・ガバナンス・コード適用以降のコーポレート・ガバナンス報告書直近の提出日、2021年12月28日。
<基本的な考え方>
当社は、医薬品開発のノウハウ・技術をもって新薬の誕生・成長に貢献し、国内外のバイオベンチャーから大手製薬企業、医療機関のパートナーとして医療の発展に貢献し、患者様ならびに社会全体の期待に応えてまいります。 当社は、人命に関わる事業活動を行うため、当社の役員ならびに従業員には専門性のみならず高い倫理観が求められることから、コンプライア
ンスの徹底をはじめとした企業行動規範の遵守を徹底しております。また、内部統制の充実を図り、経営の健全性・透明性を確保することで、事業の発展とあわせて企業価値の向上に努めております。
<コーポレート・ガバナンス・コード各原則の実施について>
実施をしないコードのおもな原則と理由
|
原則 |
実施しない理由 |
|
【補充原則1-2④ 株主総会における権利行使】 |
当社は、株主が議決権行使を行いやすい環境の整備は必要であると認識しております。議決権の電子行使を可能とするための環境作り(議決権電子行使プラットフォームの利用等)や招集通知の英訳については、機関投資家並びに海外投資家の比率等を勘案しながら、導入を検討してまいります。 |
|
【原則1-3 資本政策の基本的な方針】 |
当社は、株主価値を中長期的に高め、持続的成長を実現するため、財務健全性の確保と持続的成長に向けた戦略的投資を行います。 具体的には、財務健全性の確保については、成長投資とリスクを許容できる株主資本の水準を保持することを基本とします。持続的成長に向けた戦略的投資については、内部留保資金を、将来の事業発展に必要不可欠な国際共同治験への体制構築のための投資やM&Aによる拠点拡充などに活用し、資本効率の向上に努めます。 株主への利益還元である配当については、中長期的な成長による企業価値向上と利益還元のバランスの最適化を図ることを基本方針とし、安定的な利益還元に努めます。 以上の資本政策の基本的な方針に関し、今後、Webサイト上等でご説明できるよう検討してまいります。 |
|
【補充原則2-4① 中核人材の登用等における多様性の確保】 |
当社では、多様性の確保の自主的かつ測定可能な目標を現時点において定めておりませんが、【コーポレートガバナンス・コードの各原則に基づく開示】の補充原則2-4①に係る記載のとおり、当社グループでは、女性、中途採用者等の多様性確保は一定程度進んでいるものと判断しております。今後も多様な人材の活躍を推進し、従業員一人ひとりがそれぞれの能力・特性を最大限に発揮できるよう環境の整備や人材の育成を継続的に行ってまいります。 |
|
【補充原則3-1② 海外投資家等の比率等を 踏まえた英語での情報の開示・提供の推進】 |
2022年3月期第1四半期より、(四半期)決算短信のサマリー及び連結財務諸表の英語での情報開示を開始いたしました。また、今後、株主総会の招集通知や決算説明会資料等の英語での情報開示についても検討を行ってまいります。 |
|
【補充原則3-1③ サステナビリティについての取組み等】 |
当社は「医薬品開発のあらゆる場面で常にプロフェッショナルとしての質を提供し、ステークホルダーである製薬会社、医療機関、患者ならびに株主、従業員の幸せを追求する。」という経営理念に基づき、社会と共に持続可能な発展を目指しております。具体的には、「革新的な医薬品の開発支援」及び「医薬品の安全性の確保」の2つの使命を常に念頭に、役員・従業員一人ひとりが「社会的責任」を意識しながら、誠実さをもって企業活動を遂行することで、世界中の人々の健康で豊かな生活に貢献することにより、当社の持続的な成長と中長期的な企業価値の向上が達成されると考えております。SDGsの開発目標との関連では、当社ビジネスである医薬品開発支援を通じた社会貢献により「SDGs3:すべての人に健康と福祉を」、人材育成やダイバーシティの推進により「SDGs5:ジェンダー平等を実現しよう」、「SDGs8:働きがいも経済成長も」について実質的な取組みを行っております。以上の考え方や現在の状況、事業計画等に基づき、当社のサステナビリティをめぐる取組みについての基本方針、情報開示の枠組みや具体的な重要課題について、現在検討しております。 |
|
【補充原則4-2② 自社のサステナビリティを巡る取組みについての基本方針の策定等】 |
【コーポレートガバナンス・コードの各原則を実施しない理由】<補充原則3-1③ サステナビリティについての取組み等>に記載のとおり、当社のサステナビリティを巡る取組みについての基本方針、取組み等については、現在検討中であります。 |
|
【補充原則4-10① 独立した指名委員会・報酬委員会の設置による独立社外取締役の適切な関与・助言】 |
当社は、独立社外取締役は現在2名であり、各取締役、経営陣との連絡・調整、監査役との連携体制は構築されており、取締役会において、指名・報酬などについても十分な議論を行い、コーポレートガバナンス・コードの趣旨にのっとった実効性の高い審議・監督は出来ていると考えております |
<開示している主な原則>
|
原則 |
開示内容 |
|
【原則1-4 政策保有株式】 |
当社は、株価変動というリスクの回避のため、また資本効率の向上のためという2つの理由から、協業・提携のための株式保有等の必要がある場合を除き、上場株式を保有しません。 |
|
【補充原則2-4① 中核人材の登用等における社内の多様性の確保】 |
1 多様性確保についての考え方当社グループは、多様な人材の活躍を推進し、従業員一人ひとりがそれぞれの能力・特性を最大限に発揮できるよう環境の整備や人材の育成を行います。2 中核人材の多様性推進に関する状況(1)女性2021年11月末時点の日本本社の全社員に占める女性社員比率は44.4%であります。また、執行役員の女性比率は16.7%、管理職の女性比率は19.4%です。グループ全体では、2021年11月末時点の全社員に占める女性社員比率は58.6%であります。また、執行役員の女性比率は25.0%、管理職の女性比率は36.5%です。(2)外国人2021年11月末時点の日本本社の全社員に占める外国籍社員比率は6.6%であります。また、管理職の外国籍社員比率は1.9%です。グループ全体では、2021年11月末時点の全社員に占める各社所在地国を基準とした外国籍社員比率は7.4%であります。また、執行役員の外国籍社員比率8.3%、管理職の外国籍社員比率は3.3%です。(3)中途採用者2021年11月末時点の日本本社の全社員に占める中途採用者比率は40.8%であります。また、執行役員の中途採用者比率は100%、管理職の中途採用者比率は59.7%です。グループ全体では、2021年11月末時点の全社員に占める中途採用者比率は63.9%であります。また、執行役員の中途採用者比率は100%、管理職の中途採用者比率は70.4%です。3 多様性の確保に向けた人材育成方針、社内環境整備方針、その状況当社では、多様性確保についての考え方に基づき、下記のような制度等を制定・実施しております。・社内制度週休3日制勤務制度、産前産後休業制度、育児休業制度、フレックスタイム勤務制度、退職者復職登録制度規程等の制度を運用しております。・採用…(年齢)2021度は20代~60代までの幅広い年代の採用を行っております。・国籍…2017年以降、外国籍採用に数値目標を持って取り組み、毎年採用を行っております。・研修…2019年度以降「異文化理解」に関する全社研修を毎年実施しております。 |
|
【補充原則4-11① 取締役会のバランス、 多様性及び規模に関する考え方】 |
当社は、医薬品開発を主たる事業としております。このため取締役会は、迅速かつ的確な意思決定ならびに執行の監督が行えるよう、新薬開発をはじめとした医薬品業界の業務に精通し、深い知識・経験を有する者を中心に構成しています。さらに、財務・会計の専門知識を有する者、海外で当該事業のグローバル展開を経験した者等がガバナンスの充実や成長戦略に関して積極的に意見を述べ、活発な議論が行える体制を整えています。現在、取締役会は独立社外取締役2名を含む9名で構成されており、このうち女性を1名含んでおります。また、独立社外取締役2名は、他社で代表取締役社長等を歴任するなど豊富な経営経験を有しております。 |
|
【補充原則4-11③ 取締役会の実効性評価】 |
当社取締役会は、(取締役1名が期中辞任のため)取締役10名、監査役3名へのアンケート及びその結果に基づく討議にて、取締役会の実効性を以下のとおり評価いたしました。 1.取締役会の構成 人数規模、社内外取締役の割合、知識・経験・専門性・性別などの多様性の観点で肯定的な回答が多く、適切であると評価できるが、中長期的な成長に向けた課題として、グローバル化やDX対応等への専門性強化や経験蓄積が望まれる。 2.取締役会の運営 開催頻度、議題の整備、資料の効率化や早期配布など肯定的回答が多く、適切であると評価できる。 3.議論の活性化、内容審議時間と内容、発言量、迅速かつ柔軟な意思決定、業務監督(モニタリング)等については肯定的な回答が多く、適切であると評価できる。一方で、戦略的な重要議案により多くの時間を割き議論の質を向上させるために、社外取締役への事前説明のより一層の充実を求める回答もみられた。 なお、当社では、重要な審議事項については、取締役会に先立ち、社内取締役と執行役員が日頃より密接なコミュニケーションをとり経営会議な どで事前審議を行うとともに、社外取締役に対しては、毎月の定例取締役会に先立ち事前に資料を提供しCFOおよび経営企画室から説明と質疑応答を実施することで、取締役会での意思決定における適切性・妥当性を確保しております。以上より、取締役会の実効性は確保されている旨の結論を得ました。2022年3月期以降も引き続き戦略課題の審議を充実させ、実効性を高めるためのモニタリングや議論を続けてまいります。 |
|
【原則5-1 株主との建設的な対話に関する方針】 |
当社では、企業と株主(潜在株主としての機関投資家や個人投資家を含む)の共通目的である企業価値の持続的成長を目指し、信頼関係を構築 するために、業績、経営戦略、資本政策、リスク、コーポレートガバナンス体制などについて以下の方法により継続的・建設的で透明・公正な対話を実施しております。 -株主との対話は専務取締役CFOが統括を行い、面談の目的と効果、株主属性を勘案し、代表取締役社長、専務取締役CFOを中心とした経営幹部により対話者と対話方法を検討のうえ実施しています。 -IRは財務部ならびに経営企画室が中心となり社内関連部署から必要情報を収集し、分かり易い資料作成や説明により株主との対話を充実させています。 -定時株主総会、決算説明会(年2回)、個人投資家向け説明会(年2回)、四半期決算開示毎の国内外機関投資家・アナリストとの会議、ホームページでのIR情報開示、個人投資家様からの電話・メール等による問い合わせへの個別対応などを通じて対話の機会を持ち、質問や要望、説明会での参加者情報やアンケート結果などをIR活動へ反映しています。 -株主との対話を通じて把握した株主の関心や懸念は専務取締役CFOに集約し、経営分析や情報開示の在り方などの検討に活かしています。 -IR活動や株主との対話においては、社内規程の定めるところに従い、適切にインサイダー情報を管理しております。なお、当社では決算情報に関する対話を控える沈黙期間を四半期決算期日の翌日から決算短信発表日までを沈黙期間としております。 |

