(4598) Delta-Fly Pharma株式会社 DFP-10917は米国のパイプライン中最も開発が進む
 江島 淸 社長 |
Delta-Fly Pharma株式会社(4598) |
 |
企業情報
|
市場 |
東証マザーズ |
|
業種 |
医薬品(製造業) |
|
代表取締役社長 |
江島 淸 |
|
所在地 |
徳島県徳島市川内町宮島錦野37-5 |
|
決算月 |
3月末日 |
|
HP |
株式情報
|
株価 |
発行済株式数 |
時価総額 |
ROE(実) |
売買単位 |
|
|
1,412円 |
4,504,600株 |
6,360百万円 |
-31.0% |
100株 |
|
|
DPS(予) |
配当利回り(予) |
EPS(予) |
PER(予) |
BPS(実) |
PBR(実) |
|
0.00円 |
– |
-244.85円 |
– |
801.93円 |
1.8倍 |
*株価は2/17終値。発行済株式数、DPS、EPSは20年3月期第3四半期決算短信より。ROE、BPSは前期実績。
業績推移
|
決算期 |
売上高 |
営業利益 |
経常利益 |
当期純利益 |
EPS |
DPS |
|
2016年3月(実) |
145 |
-584 |
-595 |
-597 |
-185.53 |
0.00 |
|
2017年3月(実) |
902 |
328 |
323 |
305 |
88.31 |
0.00 |
|
2018年3月(実) |
150 |
-243 |
-244 |
-246 |
-71.20 |
0.00 |
|
2019年3月(実) |
– |
-592 |
-671 |
-673 |
-170.16 |
0.00 |
|
2020年3月(予) |
– |
-1,066 |
-1,066 |
-1,069 |
-244.85 |
0.00 |
*単位:円、百万円。予想は会社側予想。2018年6月25日付で1:500の株式分割を実施。EPSは遡及調整。
Delta-Fly Pharma株式会社の業績動向、開発状況の進捗などをご紹介します。
目次
今回のポイント
1.会社概要
2.業績動向
3.成長戦略
4.今後の注目点
<参考:コーポレートガバナンスについて>
今回のポイント
- 既存の抗がん活性物質等を「モジュール」(構成単位)として利用し、用法用量や結合様式等に創意工夫を加えて組み立てることで臨床上の有効性と安全性のバランスを向上させた副作用の少ない新規抗がん剤を創製する「モジュール創薬」という独自コンセプトで抗がん剤を開発。
- 「モジュール創薬」は治療効果の向上、副作用消失、低コストといった患者メリットに加え、特許化による高い排他性、迅速な開発スピード、低開発リスクといった開発上のメリットも大きい。同社では現在6つの製品・開発パイプラインを有し、3品目が臨床試験実施中、3品目が臨床試験準備中である。
- モジュール創薬の他、抗がん剤開発への特化、経験豊富なメンバーによる開発、外部資源の有効活用による効率的な企業運営なども同社の特徴。
- 20年3月期第3四半期は、前年同期同様、マイルストーン等はなく、事業収益は計上されなかった。各開発パイプラインの進捗に伴い、治験実施医療機関、症例数増加への対応、新規の臨床試験などの準備などを行ったことから、研究開発費は前年同期比277.8%増の10億31百万円となり、事業費用は同188.5%増の12億23百万円となった。営業損失は前年同期比7億99百万円拡大の12億23百万円となった。
- 20年3月期の業績予想に変更はない。事業収益については、臨床試験の進捗状況及びライセンス交渉の不確実性を考慮し、今後、収益が確実になった段階で見通しを明らかにしていく予定。一方事業費用については、DFP-10917は臨床第III相試験を米国で進めるのを始め開発パイプラインの進展に伴い、臨床試験の費用が前期よりも多くなるため、研究開発費は前期比4億45百万円増加の8億22百万円を見込んでいる。これにより営業損失は前期比4億74百万円拡大の10億66百万円となる見込み。
- 米国で臨床第Ⅲ相試験が始まったDFP-10917は同社のパイプライン中最も開発が進捗している。2019年11月からは患者登録も開始された。「製薬企業への新規ライセンスアウト」に関するリリースと合わせ、引き続き進捗を注視したい。
1.会社概要
『「がん」だけを見ることなく、「がん患者」の全体を診ることにより、安心して身内のがん患者に勧められる治療法を提供すること』を企業理念に、既存の抗がん活性物質等を「モジュール」(構成単位)として利用し、用法用量や結合様式等に創意工夫を加えて組み立てることで臨床上の有効性と安全性のバランスを向上させた副作用の少ない新規抗がん剤を創製する「モジュール創薬」という独自コンセプトで抗がん剤を開発。
【1-1 沿革】
徳島県出身の江島社長は、名古屋工業大学卒業、東京工業大学修士課程修了後、地元徳島県の製薬企業である大塚グループに就職し、その事業会社の一つ大鵬薬品工業に配属となった。
入社後すぐに早稲田大学理工学部に留学し、約12年間、研究者として医薬品、特に、機能性高分子から成る新薬の開発に関する研究に取り組む。その後、大鵬薬品工業の医薬品のシーズ探索を担当する部門在籍時、米国バイオベンチャーのマネジメントのあり方などを目の当たりにした際、大手製薬企業の研究開発組織で開発に携わるのではなく、独立して自分の力で製薬会社をマネジメントし、新しいアプローチで創薬を行いたいという意欲が強く湧き上がる。同時に、単に創薬を目指すのではなく、目の前にいる患者に何をしてあげられるのかを常に考えながら、ビジネスとして成立させることを目指し、2010年、江島社長61歳の時、大鵬薬品工業を退任し、Delta-Fly Pharma株式会社を設立。モジュール創薬による副作用の少ない患者に優しい抗がん剤開発に取り組んでおり、2019年9月現在6つの製品・開発パイプラインを有している。
2018年10月、東証マザーズに上場した。
【1-2 企業理念・経営理念】
社名「Delta-Fly」は「Dragonfly(とんぼ)」に由来している。とんぼは前にしか進まず退かないところから「不退転」の精神を象徴し、「勝ち虫」とも呼ばれていることから、強い意志をもって医薬品開発を行う決意を表している。
| 企業理念 | 「がん」だけを見ることなく、「がん患者」の全体を診ることにより、安心して身内のがん患者に勧められる治療法を提供すること |
後述するように、同社は「がん」に打ち勝つことのみを目的とする抗がん剤を開発するのではなくのではなく、抗がん剤の大きな課題である副作用を軽減し、価格も含め患者およびその家族が安心して用いることのできる抗がん治療を提供することを自社の社会的存在意義であると認識している。
【1-3 同社を取り巻く環境】
厚生労働省「平成30年(2018)我が国の人口動態統計」によれば、2016年の主な死因別死亡率(人口10万人に対し何人が死亡したか)は悪性新生物(がん)が、298.3人で第1位であった。1981年に死亡率142.0人で、同134.3人の脳血管疾患に代わり第1位となって以来30年以上にわたり連続して第1位であり、その数値も年を追って上昇している。
高齢化、また食生活を含めたライフスタイルの変化等によりがん発症率は上昇していると言われている。
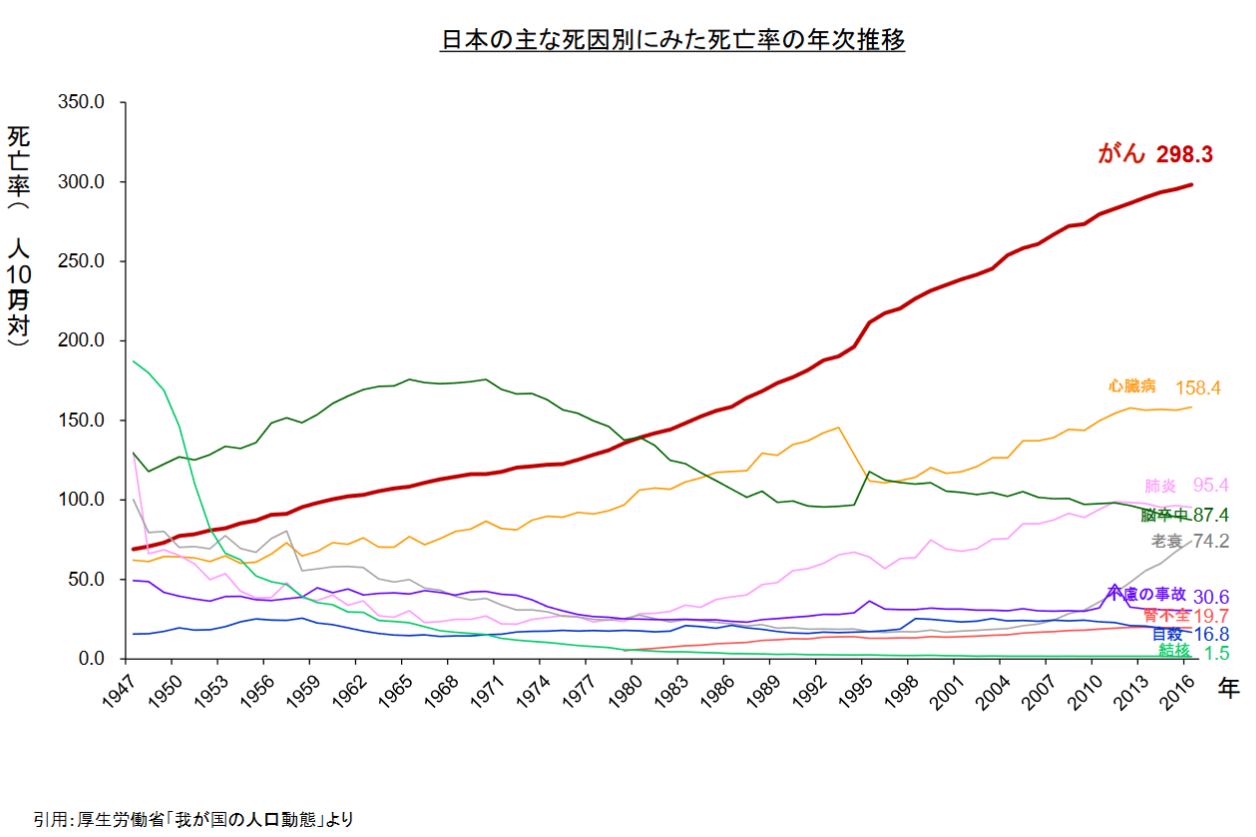
(同社資料より)
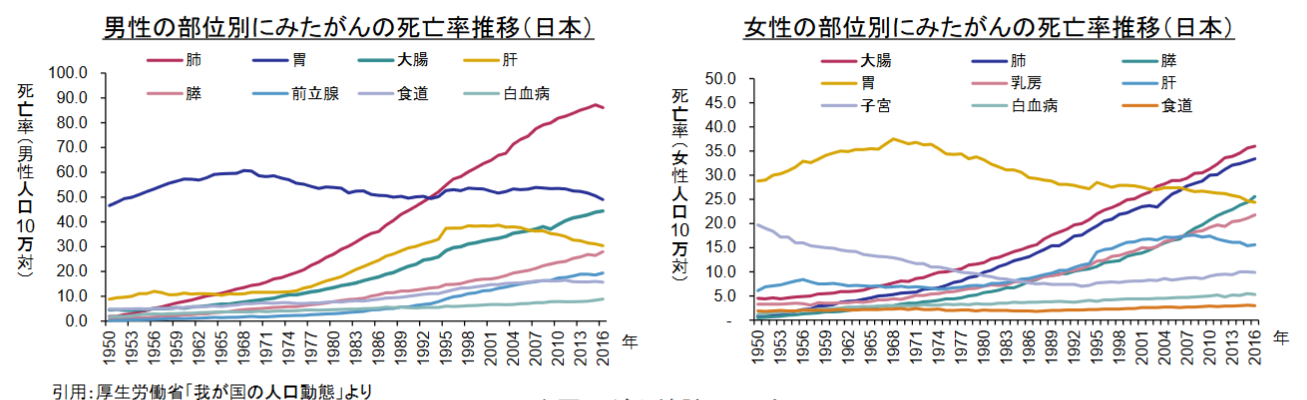
(同社資料より)
こうした状況に対し、様々な抗がん剤が用いられ、新薬の開発も行われているが、周知のように抗がん剤治療に伴う各種副作用は、がん患者にとって大きな負担であり、患者のQOL(Quality Of Life:生活の質)向上の観点から副作用の軽減ニーズは極めて大きなものとなっている。
(副作用発生の仕組み)
がん細胞は、急速に分裂して成長するので、抗がん剤は、成長の速い細胞を殺すように作られている。しかし同時に健康な細胞にも、骨髄で造られる血液細胞、消化器の細胞、生殖器の細胞、毛根細胞など急速に細胞分裂するものがあり、抗がん剤はがん細胞だけでなくこれらの正常細胞にも影響を与えてしまい、嘔気、嘔吐、脱毛、疲労感といった副作用を引き起こす。
【1-4 事業内容】
同社の創薬方法:モジュール創薬
多くのバイオベンチャーがある中で、同社を最も特徴づけるのが同社の創薬コンセプト「モジュール創薬」である。
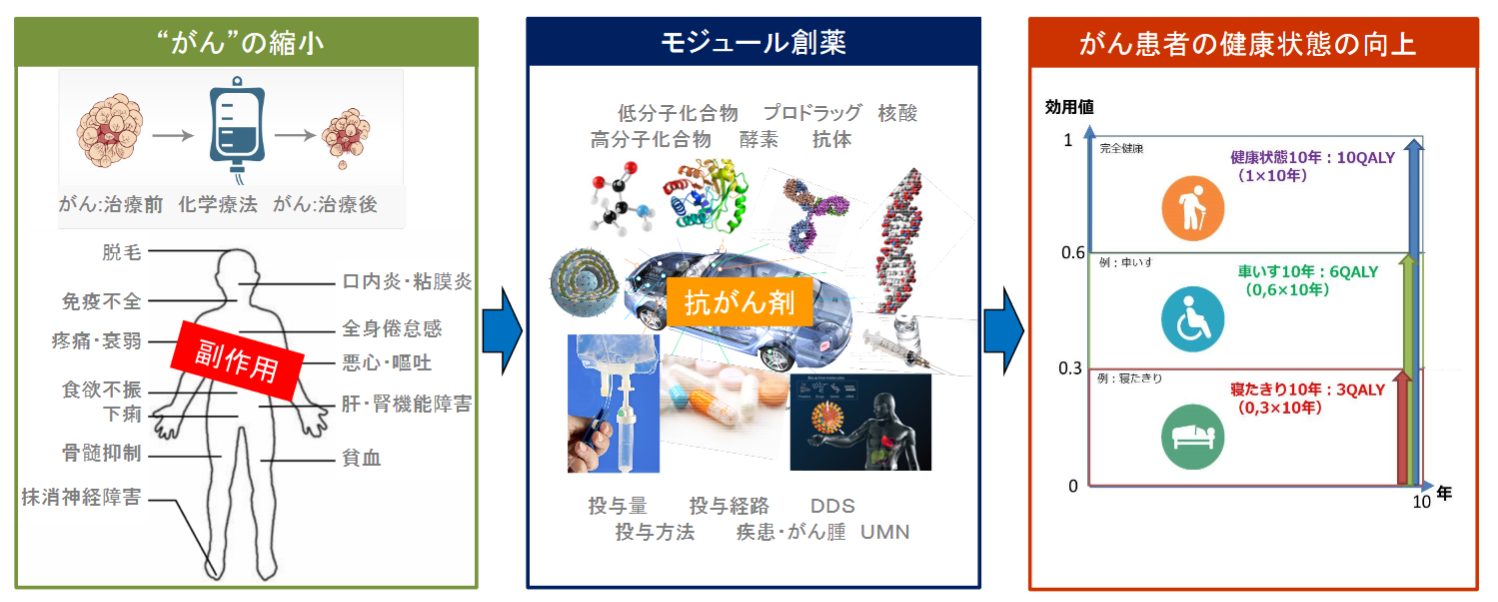
(同社資料より)
既存の抗がん活性物質等を「モジュール」(構成単位)として利用し、用法用量や結合様式等に創意工夫を加えて組み立てることで臨床上の有効性と安全性のバランスを向上させた新規抗がん剤を創製するのが「モジュール創薬」である。
「モジュール創薬」では「がん」だけを見ることなく、「がん患者」の全体を診ることによって、未だに効果が限定的で多くの様々な副作用のある抗がん剤を複合的に改良して、副作用の少ない安心して身内のがん患者に勧められる薬剤にする。
(モジュール創薬の優位性)
| 患者へのメリット | ◇ 患者情報に基づく創薬だから治療効果が上がる。
◇ 患者情報に基づく創薬だから従来の副作用が消失する。 ◇ 基礎と臨床試験が少なく短期間だからコストが低い。 |
| 開発上のメリット | ◇ 新規性・進歩性により特許化できるから高い排他性を有する。
◇ 患者情報に基づく開発だから開発スピードが速い。 ◇ 患者情報に基づく開発だから開発リスクが低い。 |
一般的な抗がん剤の創薬においては、基礎の探索研究段階でがんの特異的な部分に作用する化合物をスクリーニングし、可能性のある化合物を抗がん剤候補とするが、臨床段階で作用を確認し、臨床試験で有効性と安全性を実証する必要があり、基礎段階からの研究開発に長い期間を要する。
これに対して、「モジュール創薬」は、既に医薬品として使用されている抗がん剤の活性物質を利用して組み合わせるため、基礎の探索研究がほとんど不要であることに加え、臨床での有効性と安全性の予測が可能であるため創薬に着手して1~2年後には臨床試験を開始できているなど、一般的な抗がん剤よりも研究開発の効率が高く、開発期間も短くなり、臨床試験で失敗する等の開発リスクが低減されている。
また、がん患者の治療上の課題に注目して、特許切れの医薬品を抗がん剤の知識とノウハウを駆使して組み合わせれば、新規の抗がん剤としての特許化が可能である。
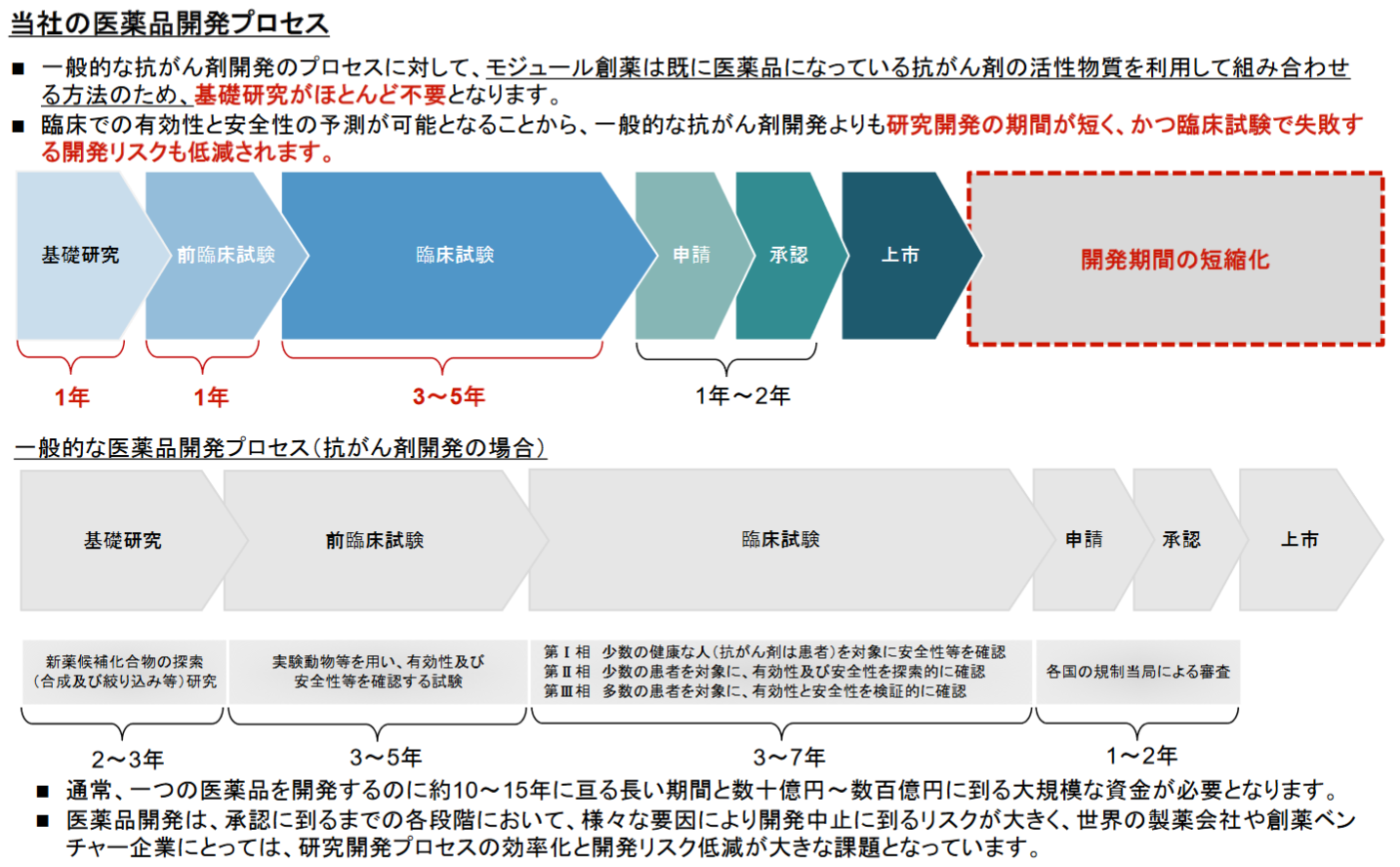
(同社資料より)
また、近年、新薬開発のコスト低減などを目的とし、製薬企業においては後発薬ジェネリックや既存薬剤から新たな薬効を見つけ出すドラッグ・リポジショニングの開発が拡大している。
これらは既存薬を利用するという点では「モジュール創薬」と同じだが、ジェネリックはもちろんだが、ドラッグ・リポジショニングにおいても新規性・進歩性が認められにくいため特許取得が困難であるのに対し、「モジュール創薬」は全て特許化された新たな薬剤に生まれ変わるという点が決定的な違いとなっている。
このように、抗がん剤の問題点を解決しようとする限り、完全に新規の抗がん剤を生み出すことが可能であることから、同社では「モジュール創薬」は新たな創薬手法の大きなイノベーションになり得ると確信している。
(2)ビジネスモデル・収益モデル
(ビジネスモデル:効率的な研究開発体制を構築)
新しい医薬品が上市されるまでには、「基礎研究」から始まり、「前臨床試験(動物を用いて薬効薬理作用、生体内での動態、有害な作用などを調べる試験)」、「臨床試験(医薬品や治療技術などの人間への影響を調べる科学的試験)」を経て、当局への申請・承認を得たのち、「製造」、「販売・マーケティング・製造販売後調査」といったプロセスを経るのが一般的である。
こうしたプロセスにおいて同社は、研究開発のマネジメント業務に集中し、具体的な業務については国内外の優れた外部の研究開発受託会社や製造受託会社に委託しており、開発フェーズに応じた外部協力機関との連携により、効率的な研究開発体制を実現している。
また、三洋化成工業株式会社(東証1部、4471)との間で、ドラッグデリバリーシステムを用いた新規抗がん剤における共同研究開発にも取り組んでいる。
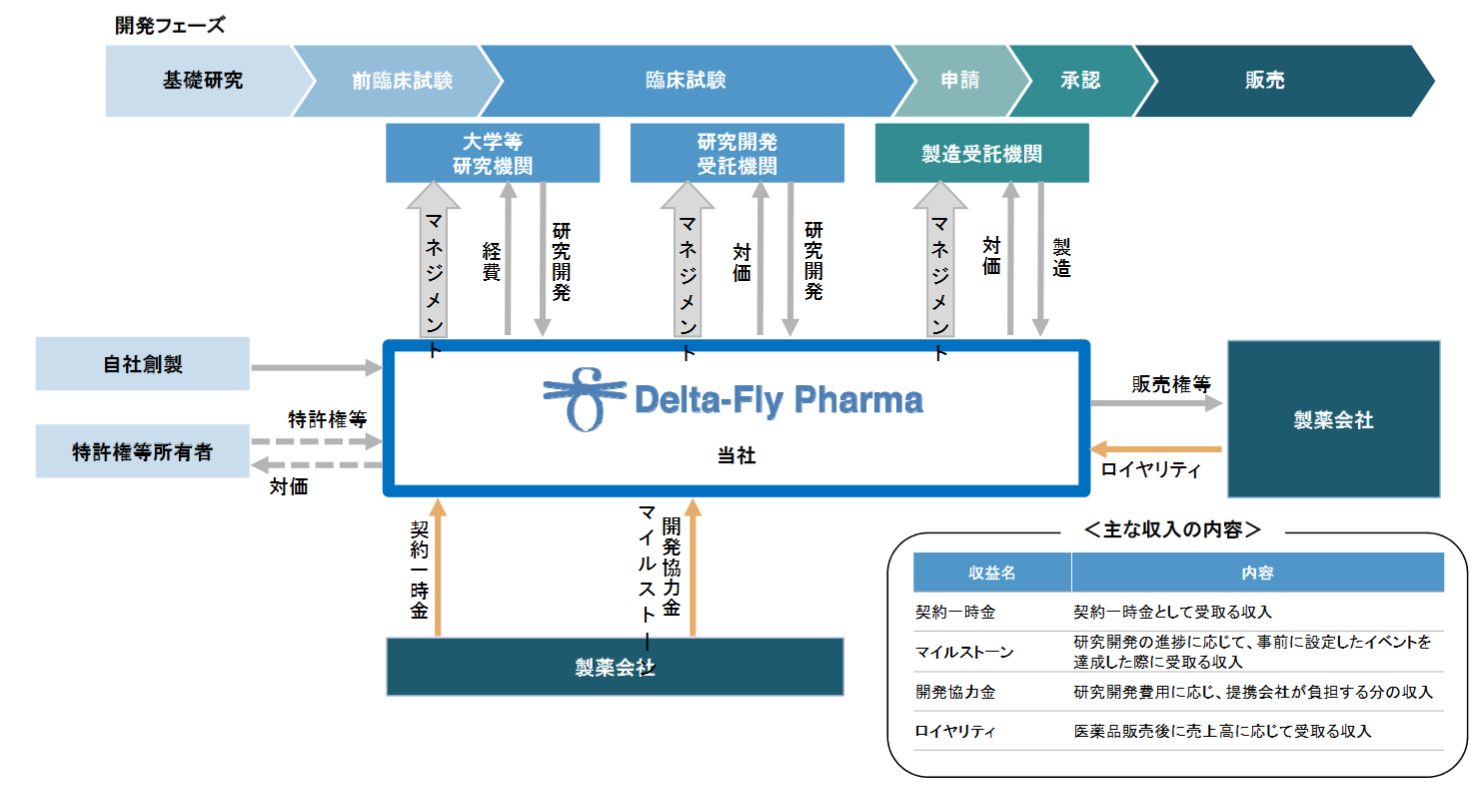
(同社資料より)
(収益モデル)
研究開発段階においては、提携製薬会社との契約に基づく「契約一時金」、「マイルストーン」、「開発協力金」が主な収入となる。将来、提携対象の製品が上市に至った場合には、売上高に応じた「ロイヤリティ」収入を受け取る予定である。
現在の提携製薬会社は以下の2社。
| 協和化学工業株式会社(未上場) | 抗がん剤候補化合物DFP-14323の日本における独占的ライセンス契約を締結 |
| 日本新薬株式会社(東証1部、4516) | 抗がん剤候補化合物DFP-10917の日本における独占的ライセンス契約を締結 |
(3)製品・開発パイプライン
現在、前述の経営方針に沿って以下6つの製品・開発パイプラインを有している。
パイプラインの開発・事業化の経緯、現状、今後の計画は以下のとおりで、3品目が臨床試験実施中、3品目が臨床試験準備中である。
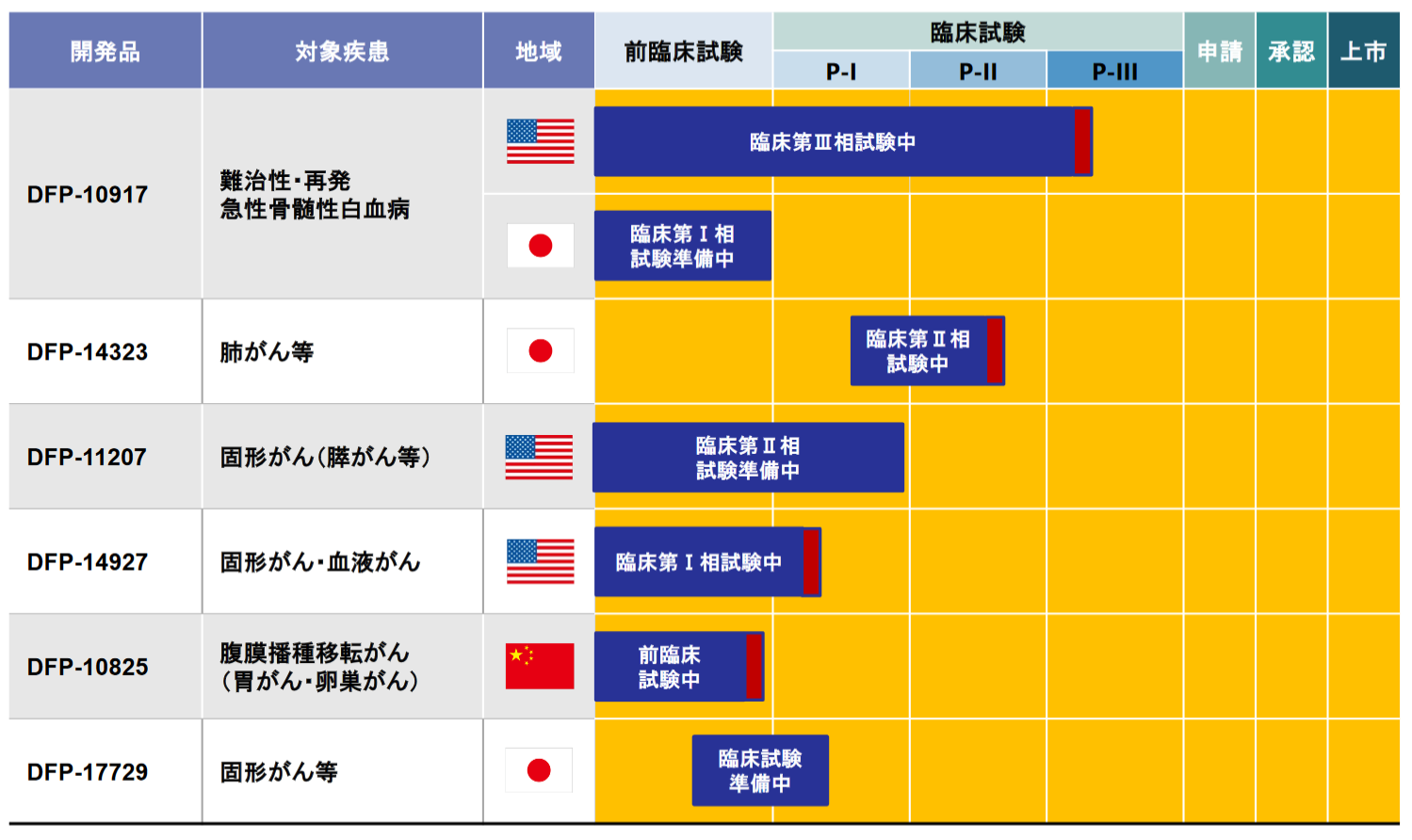
(同社資料より)
また、今期から来期にかけての各パイプラインの主なイベントの予定は以下のとおりである。
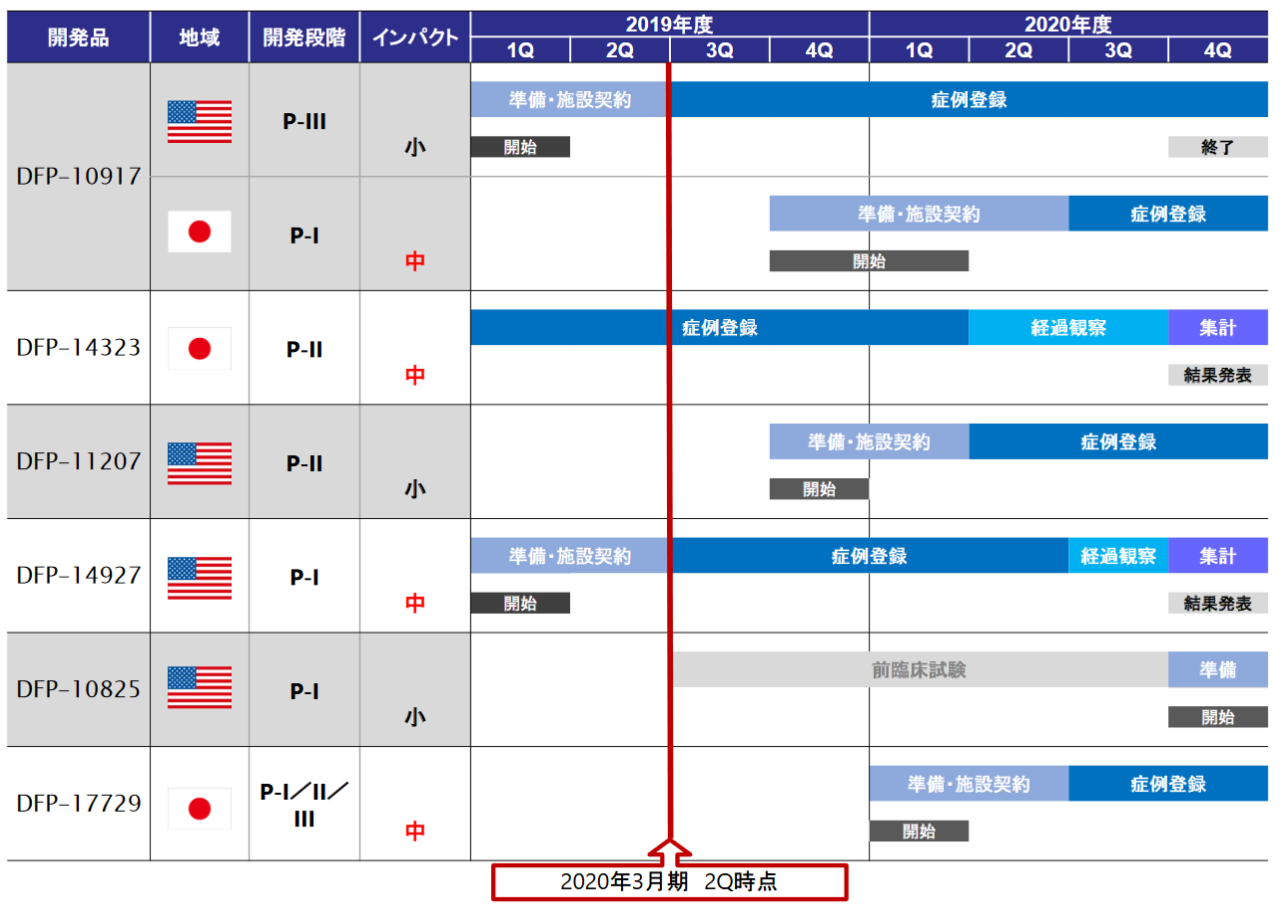
(同社資料より)
①「DFP-10917」
|
項目 |
概要 |
| 主な対象疾病 | 難治性・再発急性骨髄性白血病
(標準療法は確立されており、一時的には7割程度は血液中のがん細胞が消滅する寛解となるが、再発も多く、完全に治癒するのは全体の3割である。) |
| 既存薬の特徴など | 既存薬CNDACは固形がんを対象疾患とし、投与量は高用量・短時間で、投与経路は点滴または経口。固形がんへの効果が限定的であるのに加え重篤な副作用が散見された。 |
| モジュールの改良点・効果 | 投与量を低用量・長時間とし、投与経路も点滴による持続静注としたところ、従来使用されてきている核酸誘導体(シタラビンやゲムシタビンなど)とは異なる作用を引き起こし、既存の化学療法が無効な難治性・再発急性骨髄性白血病患者に対しても、薬効を期待できる。 |
| 特許取得国(19年10月末) | 日本、アメリカ、EU、中国、オーストラリア、韓国、ロシア |
(開発状況・今後の事業化)
米国で行われた臨床第I/II相試験では、第II相パートで48%(14/29例)の患者で奏効し、高い有用性が示唆された。
これを受け、米国規制当局(FDA)との臨床第II相試験終了時会議を経て、臨床第III相試験の治験実施計画書を提出。合意を得ることができたが、再発・難治急性骨髄性白血病の治療体系の変更に伴い第III相試験のプロトコールの一部を改訂の上、米国FDAに再提出し、臨床第III相試験が始まった。スタートアップミーティングを実施し、被験者スクリーニングを開始、2019年11月には2例の症例登録が行われた。
2021年度までの第III相試験終了、2022年度までの米国での承認・販売を目指している。
日本国内については、ライセンス先の日本新薬株式会社で臨床第I相試験の準備中で、医薬品医療機器総合機構の対面助言を受けた。
②「DFP-14323」
|
項目 |
概要 |
| 主な対象疾病 | 末期の肺がんなど |
| 既存薬の特徴など | 既存薬べスタチン(ウベニメクス)は血液がんを対象疾患とし、投与量は高用量で、投与方法は単剤。経路は点滴または経口。血液がんのみの適応だが、肺がんで延命効果があった。 |
| モジュールの改良点・効果 | 抗腫瘍効果の増強を目的とし投与量を低用量、投与方法を分子標的治療薬との併用としたところ、肺がんでの効果が確認された。がん患者の免疫機能を改善し、末期又は高齢の固形がん患者の治療が期待できる。 |
| 特許取得国(20年1月末) | 日本、アメリカ、EU、オーストラリア、ロシア、韓国、中華民国 |
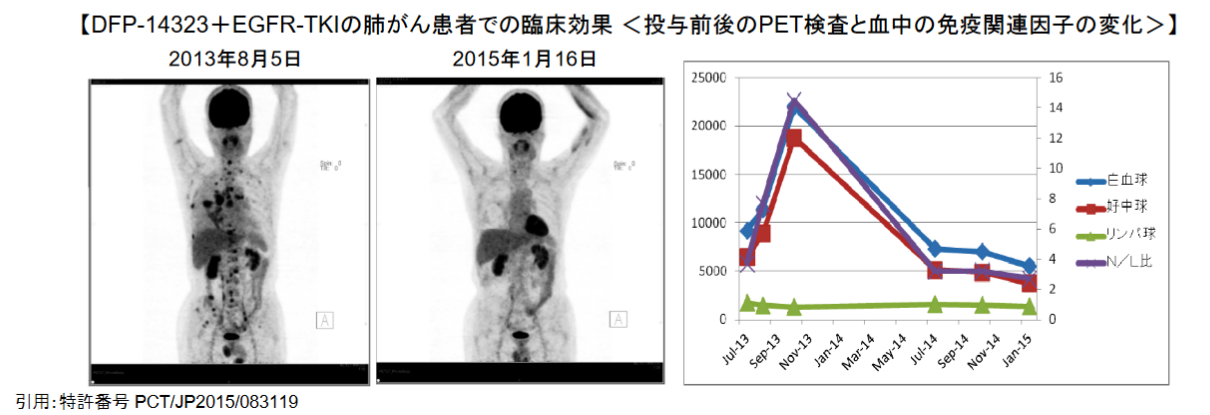
(同社資料より)
(開発状況・今後の事業化)
既存薬ウベニメクスは日本において、日本化薬(株)が、「成人急性非リンパ性白血病に対する完全寛解導入後の維持強化化学療法剤との併用による生存期間の延長」の効能・効果で承認済。
Delta-Flyは適応追加として、「EGFR 遺伝子変異陽性非小細胞肺がん患者を対象とした低用量EGFR-TKI 併用治療の臨床第II相試験」を2018年1月から日本国内で開始し、国内治験参加施設の拡大により、新規症例の登録を進めた。
2023年度までに日本での適応追加の承認・販売を目指している。
協和化学工業株式会社(未上場)と日本における独占的ライセンス契約を締結している。
③「DFP-11207」
|
項目 |
概要 |
| 主な対象疾病 | 進行再発膵臓がん胃がん |
| 既存薬の特徴など | 既存薬ティエスワンは血小板減少を含む血液毒性により治療の継続が不充分であった。 |
| モジュールの改良点・効果 | DFP-11207は抗がん作用を有する5-フルオロウラシル(5-FU)の薬物動態を制御するために、徐放・阻害・失活させる3つのモジュール化された活性物質(モジュールI、II、III)を結合した化合物。
従来の5-FU系抗がん剤で発現する血小板減少を含む血液毒性が回避されており、有効性と安全性のバランスが改善され、長期に継続して治療することが可能となった。 化合物の組み合わせを改良した「モジュール創薬の代表例」。 |
| 特許取得国(19年10月末) | 日本、アメリカ、EU、中華人民共和国、オーストラリア、韓国、ロシア、中華民国、香港 |
(開発状況・今後の事業化)
米国にて固形がん(消化器がん)を対象に臨床第I相試験を進め、次試験の推奨用量と従来の5-FU系抗がん剤で発現していた血小板減少の副作用がないことを確認した。
現在、食事の影響試験が終了し、その総括作業と、治験責任医師との協議を行い、抗がん剤併用の第II相試験の治験計画を取りまとめた。
第I相試験と食事の影響試験の結果を中国臨床腫瘍学会(CSCO)と日本癌治療学会(JSCO)で発表した。
2024年度までに米国または中華人民共和国での承認・販売を目指している。
④「DFP-14927」
|
項目 |
概要 |
| 主な対象疾病 | 膵臓がん、胃がん、骨髄異形成症候群 |
| 既存薬の特徴など | 既存薬DFP-10917は投与には持続静注用ポーチを利用し、14日間連続の投与が必要で利便性の向上が必要であった。また対象疾患は血液がんのみであった。 |
| モジュールの改良点・効果 | ポリエチレングリコール結合を行った抗がん剤候補物質DFP-14927は、DFP-10917の高分子デリバリーであり、がん組織へ選択的に集まり、がん細胞内で効果的にDFP-10917を放出することを可能とした。
また投与回数を週1回投与に減らし、投与経路も点滴静注とし、対象疾患は血液がんに加え、固形がんや骨髄異形成症候群に広がった。 |
| 特許取得国(19年10月末) | 日本、アメリカ、中華人民共和国、オーストラリア、ロシア |
(開発状況・今後の事業化)
米国において前臨床試験が終了している。前臨床試験のデータでは、週1回投与で血液中濃度が長時間安定であることを確認しており、固形がんに対する抗腫瘍効果を認めている。
2018年3月に三洋化成工業(株)と共同開発契約を締結し、臨床第I相試験開始申請の準備を進めてきたが、2019 年1月18日、米国 FDAによる IND(Investigational New Drug:臨床試験用の新医薬品)の安全性審査が完了し、米国での臨床第I相試験の実施が許諾され、膵がん 及び胃がんを含む消化器がん患者を対象に臨床第I相試験を開始。2019年10月より2例の症例登録が行われた。
また、この臨床試験とは別に、骨髄異形成症候群を含む血液がん患者への可能性も検討する予定である。
2025年度までに米国での承認・販売を目指している。
⑤「DFP-10825」
|
項目 |
概要 |
| 主な対象疾病 | 胃がん、卵巣がん、膵臓がんの腹膜播種転移 |
| 既存薬の特徴など | 基本薬siRNAは、基礎効果としては確実な阻害効果がみとめられるが、臨床効果としては全身投与での効果に難があった。 |
| モジュールの改良点・効果 | RNA干渉を利用した核酸医薬は、がん分子標的薬やがん免疫療法剤に次ぐ、次のがん治療薬として期待されている。核酸医薬DFP-10825は、がんの増殖に多大な影響を与える因子をRNA干渉で特異的に阻害させるために、全身投与ではなく腹腔内投与で効果を発揮できるように工夫している。卵巣がんや胃がん等の患者では、終末期になると胸水や腹水などの体液貯留(腹膜播種転移)が認められるが、腹腔内に直接注入して効果を発揮することにより、腹水をコントロールして苦しさを和らげ、延命につながることが期待される。 |
| 特許取得国(19年10月末) | 日本、アメリカ、EU、中華人民共和国、韓国、ロシア、中華民国、香港 |
(開発状況・今後の事業化)
すでに卵巣がん、胃がん及び膵がんで生じる腹水の原因となる腹膜播種転移に対する薬効試験と薬物動態試験を終え、原薬、DDS 及び製剤などの治験薬の製造法についても現行の医薬品適正製造基準(cGMP)による予備的な検討を終えている。今後は、株式上場で得られた資金の一部を活用し、医薬品の安全性に関する非臨床試験の実施基準(GLP)による前臨床試験を追加した後、米国 FDAにIND申請の上、米国で卵巣がん、胃がん及び膵がんの腹膜播種転移の患者を対象に臨床第I相試験を開始する予定である。出願中の各国の特許証も届いている。
原薬と治験製剤の準備を進めると共に、前臨床試験を進め、2020年度までに米国または日本国内での臨床試験の開始を目指している。
⑥「DFP-17729」
|
項目 |
概要 |
| 主な対象疾病 | 末期の膵臓がん、悪性黒色腫胃リンパ腫、胃がん、肺がん |
| 既存薬の特徴など | 既存薬である尿アルカリ化剤は、高尿酸血症などを対象疾患とするものだが、膵がんで延命効果が認められたほか、各がん腫瘍で抗腫瘍効果が見られた。 |
| モジュールの改良点・効果 | 正常細胞では細胞内と比べて細胞外でアルカリ性となっているが、がん細胞の細胞外は酸性となっている。これは、がん細胞の増殖により解糖系が亢進し、乳酸や水素イオンが産生され、それを積極的に細胞外へ排出しているからである。
DFP-17729は、がん細胞の細胞外をアルカリ化することにより、がんの増殖を抑える。抗がん剤との併用、免疫チェックポイント阻害剤との併用により免疫チェックポイント阻害薬単独療法に比べて効果を増強することが動物実験で確認されている。 |
| 特許取得国(19年10月末) | 日本、韓国 |
(開発状況・今後の事業化)
医薬品として承認・販売されている尿アルカリ化剤の、日本における抗がん剤としての適応追加の準備を進めている。
尿アルカリ化剤は「アシドーシスの改善」の効能・効果で、「高尿酸血症」や「腫瘍崩壊症候群」などの治療で、すでに臨床現場で使用されているため、前臨床試験は不要。抗がん剤や免疫チェックポイント阻害剤との併用により、既存薬の抗腫瘍効果の範囲を広げ、新たながん治療の提供を目指す。2020年度までに日本国内での臨床試験の開始を目指している。
【1-5 バイオベンチャーとしての4つの特徴】
バイオベンチャーとしての同社を特徴づけるのは主に以下の4点である。
➀モジュール創薬
前述のように、既存の薬剤等を「モジュール」(構成単位)で創意・工夫して組み立てることで特許化し、臨床上の有効性と安全性のバランスを向上させた新薬を生み出している。
➁抗がん剤開発への特化
未だに効果が限定的で多くの様々な副作用がある「抗がん剤」を対象にすることで、モジュール創薬による新薬開発を加速し、がん患者の社会生活の改善に貢献している。
③経験豊富なメンバーによる開発
長年にわたり抗がん剤の研究・開発に従事してきた製薬会社経験者と、がん患者のことを良く知る臨床医から構成されるメンバーで、確実に開発を進め、アンメット・メディカル・ニーズに応えており、同社の強力な差別化要因、競争優位性となっている。
④外部資源の有効活用
工場や研究所を持たず、研究開発マネジメント業務に集中し、外部の受託機関などに委託して積極的な連携を図ることにより、効率的な運営を行っている。
2.業績動向
(1)2020年3月期第3四半期決算概要
①業績概況
|
19/3期3Q |
20/3期3Q |
前年同期比 |
|
|
事業収益 |
– |
– |
0 |
|
事業費用 |
424 |
1,223 |
+799 |
|
うち、研究開発費 |
273 |
1,031 |
+758 |
|
営業利益 |
-424 |
-1,223 |
-799 |
|
経常利益 |
-501 |
-1,229 |
-727 |
|
当期純利益 |
-503 |
-1,232 |
-728 |
単位:百万円
(事業収益)
前年同期同様、マイルストーン等はなかった。
(事業費用)
各開発パイプラインの進捗に伴い、治験実施医療機関、症例数増加への対応、新規の臨床試験などの準備などを行ったことから、研究開発費は前年同期比277.9%増の10億31百万円となり、事業費用は同188.5%増の12億23百万円となった。
(営業利益)
営業損失は前年同期比7億99百万円拡大の12億23百万円となった。
②財務状態
◎主要BS
|
19年3月末 |
19年12月末 |
19年3月末 |
19年12月末 |
||
|
流動資産 |
3,532 |
2,373 |
負債合計 |
63 |
41 |
|
現金 |
3,508 |
2,311 |
純資産合計 |
3,504 |
2,379 |
|
固定資産 |
35 |
46 |
利益剰余金 |
-2,066 |
-3,298 |
|
有形固定資産 |
31 |
43 |
負債純資産合計 |
3,567 |
2,420 |
|
資産合計 |
3,567 |
2,420 |
長短借入金残高 |
13 |
7 |
単位:百万円
自己資本比率は前期末比0.1ポイント上昇し98.3%。
(2)2020年3月期業績見通し
|
19/3期 |
20/3期(予) |
前期比 |
|
|
事業収益 |
– |
– |
0 |
|
販売管理費 |
592 |
1,066 |
+474 |
|
研究開発費 |
377 |
822 |
+445 |
|
販管費 |
215 |
244 |
+29 |
|
営業損失 |
-529 |
-1,066 |
-537 |
|
経常損失 |
-672 |
-1,066 |
-394 |
|
当期純損失 |
-673 |
-1,069 |
-396 |
単位:百万円
業績予想に変更はない。
事業収益については、臨床試験の進捗状況及びライセンス交渉の不確実性を考慮すると、現段階でのマイルストーン対価並びに契約一時金等を計上することは適切でないと考えており、今後、収益が確実になった段階で見通しを明らかにしていく予定。
一方事業費用については、DFP-10917は臨床第III相試験を米国で進めると共に、DFP-11207の臨床第II相試験及びDFP-14927の臨床第I相試験を米国で開始する予定である。また、国内においては、DFP-14323の臨床第II相試験の症例登録をさらに推進し、DFP-17729は国内の提携パートナーと共に臨床試験を開始する予定。
これらの開発パイプラインの進展に伴い、臨床試験の費用が前期よりも多くなるため、研究開発費は前期比4億45百万円増加の8億22百万円を見込んでいる。
3.成長戦略
臨床試験実施中の3品目および臨床試験準備中の3品目の開発を着実に進め、2022年度以降毎期1品目の上市を目指している。また収益の最大化を目指し、日本・中国・欧州・米国での提携パートナー確保にも注力する。
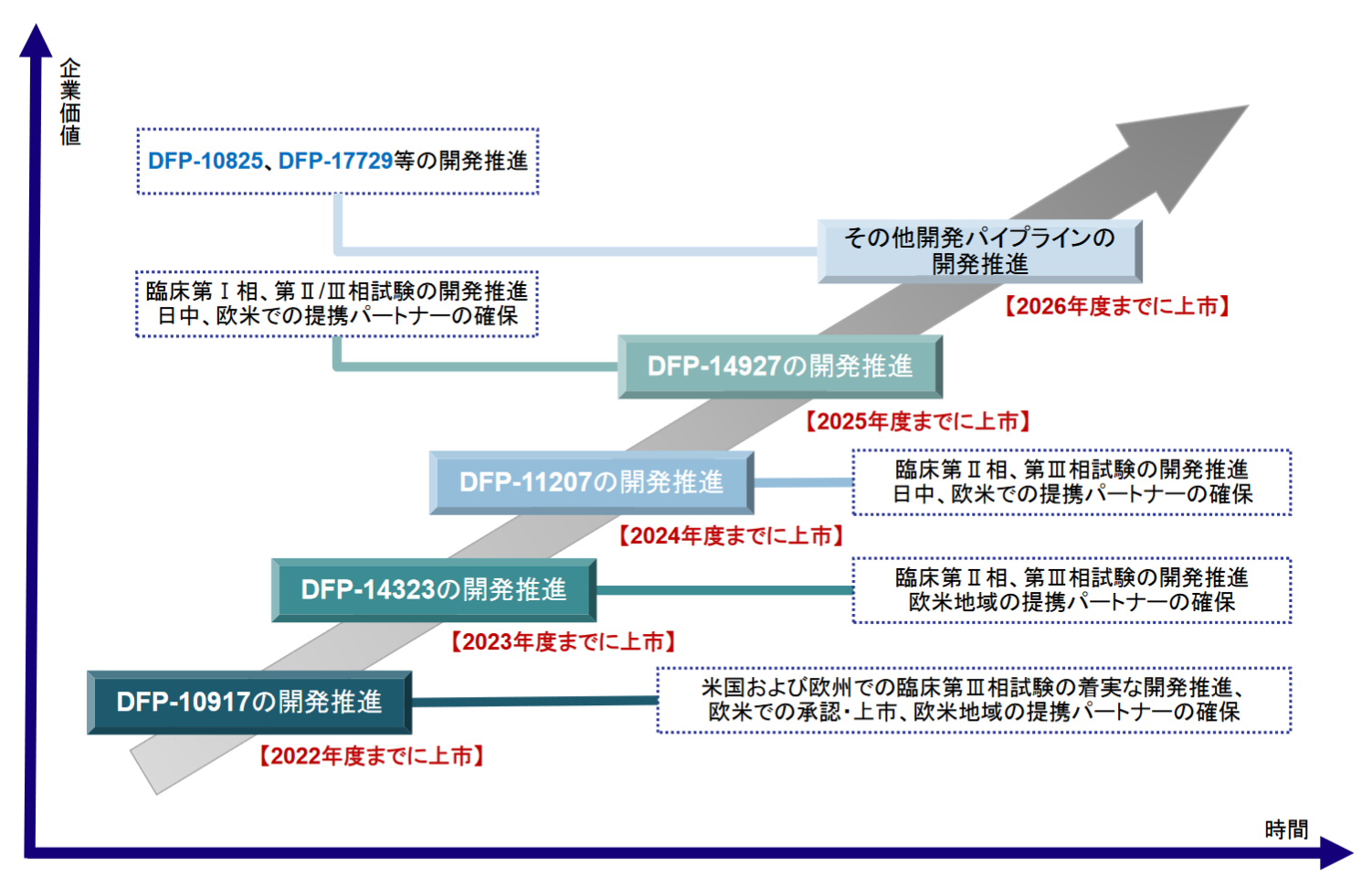
(同社資料より)
4.今後の注目点
米国で臨床第Ⅲ相試験が始まったDFP-10917は同社のパイプライン中最も開発が進捗している。2019年11月からは患者登録も開始された。「製薬企業への新規ライセンスアウト」に関するリリースと合わせ、引き続き進捗を注視したい。
<参考:コーポレートガバナンスについて>
◎組織形態、取締役、監査役の構成
| 組織形態 | 監査役会設置会社 |
| 取締役 | 7名、うち社外4名 |
| 監査役 | 3名、うち社外2名 |
◎コーポレートガバナンス報告書
最終更新日:2019年6月28日
<基本的な考え方>
当社は「「モジュール創薬」により、安心して身内のがん患者に勧められる治療法を提供する。」というミッションの下、株主をはじめ、顧客、取引先、従業員、地域社会等の全てのステークホルダーの利益を重視した経営を行うことが当社の使命であると考えています。そのためには、当社事業が安定的かつ永続的な発展を果たすことが不可欠であり、このような発展の基盤となる経営の健全性、透明性及び効率性が確保された体制の整備を進めることをコーポレート・ガバナンスの取組みに関する基本方針としています。
<コーポレートガバナンス・コードの各原則を実施しない理由>
「基本原則をすべて実施しています。」と記載している。

